OPDIVO 10 mg-ml, solution a diluer pour perfusion, boîte de 1 flacon de 4 ml
Dernière révision : 26/10/2023
Taux de TVA : 2.1%
Laboratoire exploitant : BRISTOL-MYERS SQUIBB
Mélanome
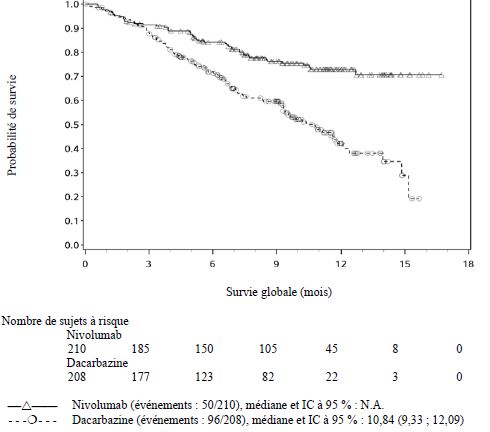
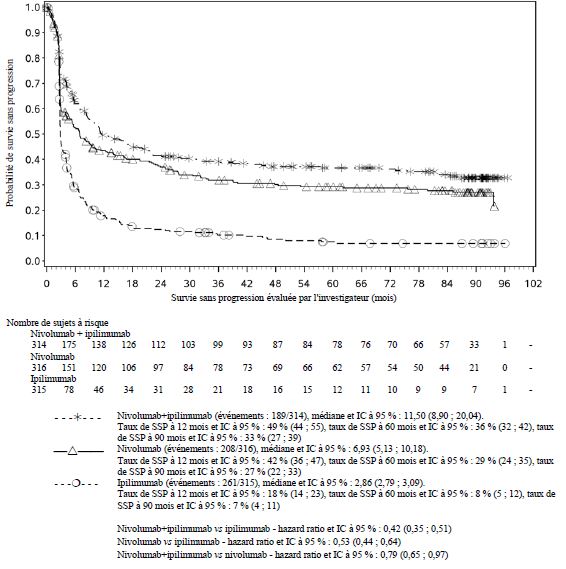
OPDIVO est indiqué en monothérapie ou en association à l’ipilimumab dans le traitement des patients adultes et adolescents âgés de 12 ans et plus atteints d'un mélanome avancé (non résécable ou métastatique).
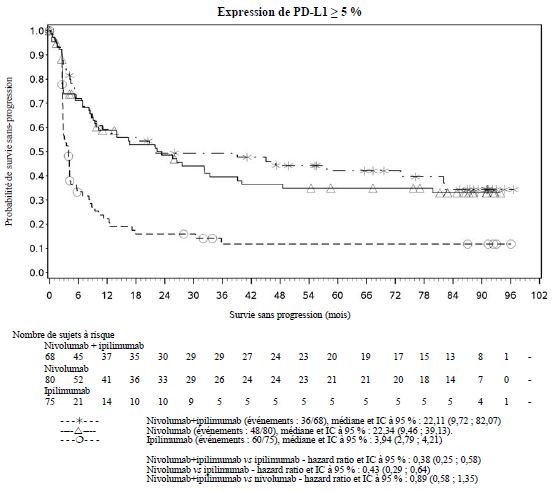
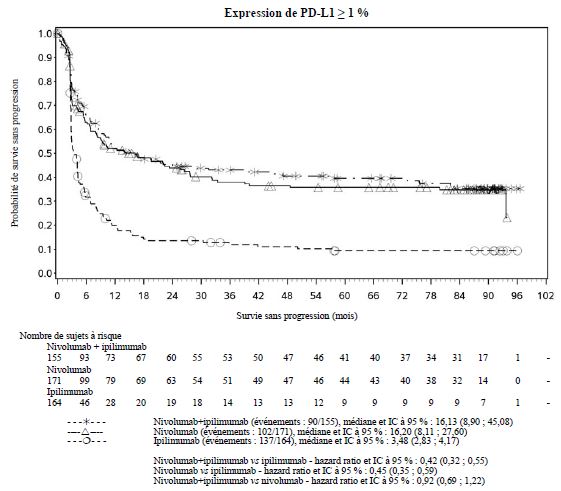
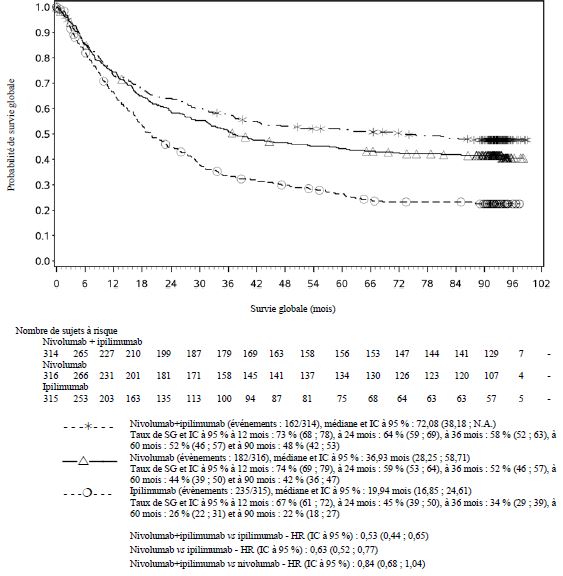
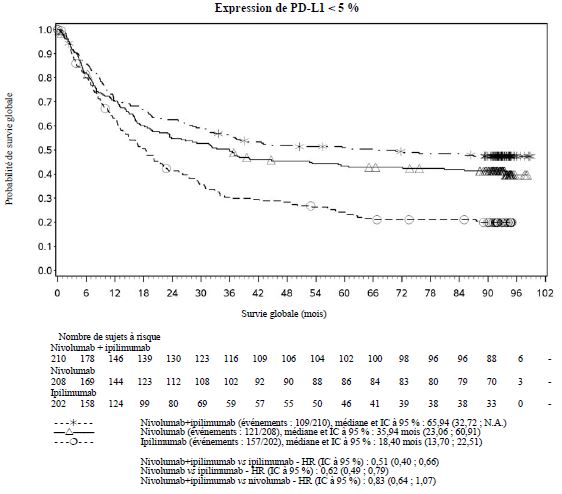
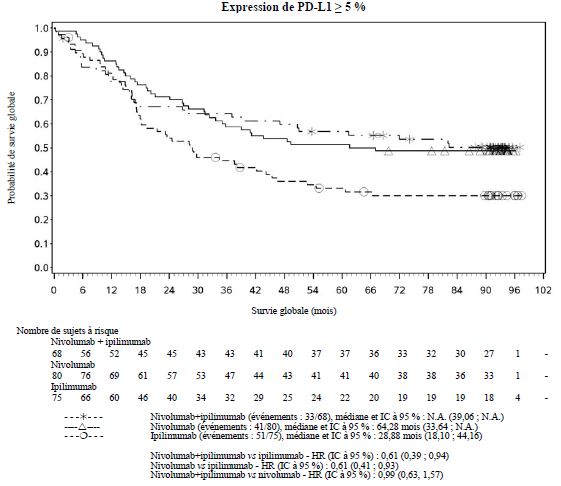
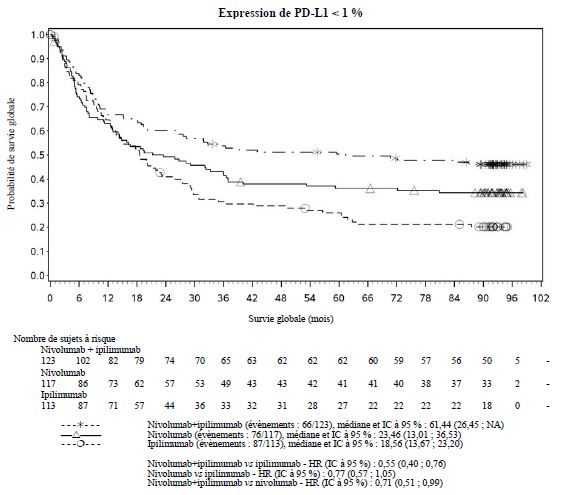
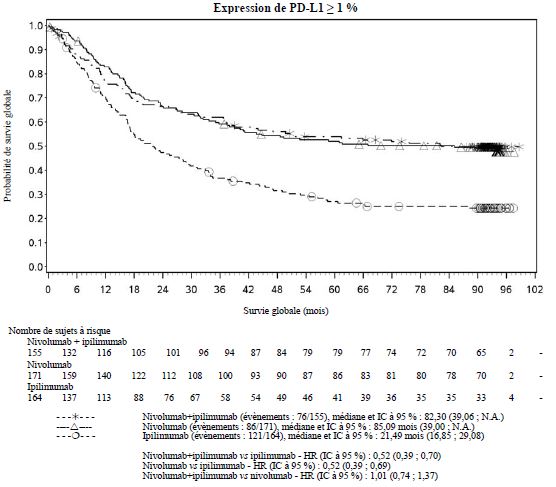
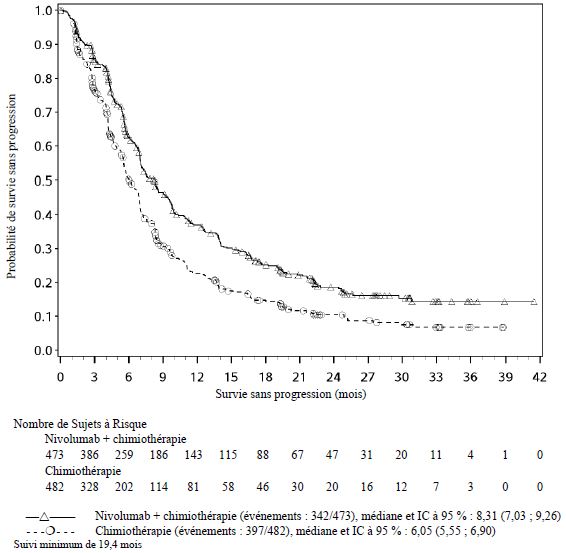
Par rapport à nivolumab en monothérapie, une augmentation de la survie sans progression (SSP) et de la survie globale (SG) a été établie pour l'association de nivolumab à l'ipilimumab seulement chez les patients avec une expression tumorale faible de PD-L1 (voir rubriques Mises en garde spéciales et précautions d'emploi et Propriétés pharmacodynamiques).
Traitement adjuvant du mélanome
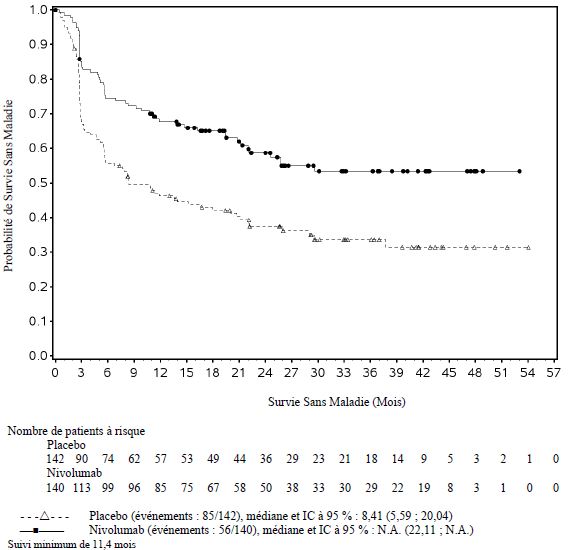
OPDIVO est indiqué en monothérapie dans le traitement adjuvant des patients adultes et adolescents âgés de 12 ans et plus atteints d’un mélanome de stade IIB ou IIC, ou avec atteinte des ganglions lymphatiques ou une maladie métastatique, et ayant subi une résection complète (voir rubrique Propriétés pharmacodynamiques).
Cancer bronchique non à petites cellules (CBNPC)
OPDIVO est indiqué en association à l'ipilimumab et à 2 cycles de chimiothérapie à base de sels de platine, en première ligne, dans le traitement des patients adultes atteints d'un cancer bronchique non à petites cellules métastatique dont les tumeurs ne présentent pas la mutation sensibilisante de l'EGFR, ni la translocation ALK.
OPDIVO est indiqué en monothérapie dans le traitement des patients adultes atteints d'un cancer bronchique non à petites cellules localement avancé ou métastatique après une chimiothérapie antérieure.
Traitement néoadjuvant du CBNPC
OPDIVO est indiqué en association à une chimiothérapie à base de sels de platine dans le traitement néoadjuvant des patients adultes, atteints d'un cancer bronchique non à petites cellules résécable à haut risque de récidive, dont les tumeurs expriment PD-L1 au seuil ≥ 1 % (voir rubrique Propriétés pharmacodynamiques pour les critères de sélection).
Mésothéliome pleural malin (MPM)
OPDIVO est indiqué en association à l'ipilimumab, en première ligne, dans le traitement des patients adultes atteints d'un mésothéliome pleural malin non résécable.
Carcinome à cellules rénales (CCR)
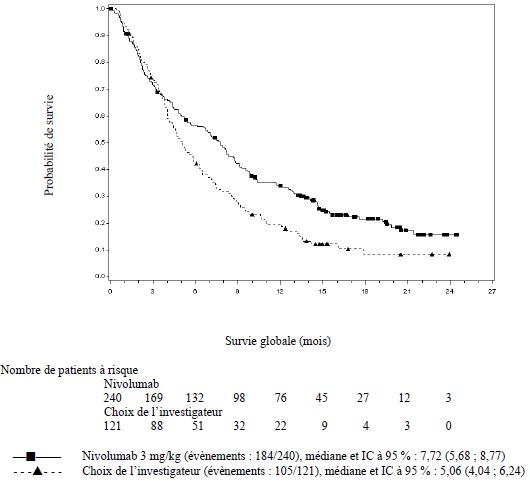
OPDIVO est indiqué en monothérapie dans le traitement des patients adultes atteints d'un carcinome à cellules rénales avancé après un traitement antérieur.
OPDIVO est indiqué en association à l'ipilimumab, en première ligne, dans le traitement des patients adultes atteints d'un carcinome à cellules rénales avancé de pronostic intermédiaire/défavorable (voir rubrique Propriétés pharmacodynamiques).
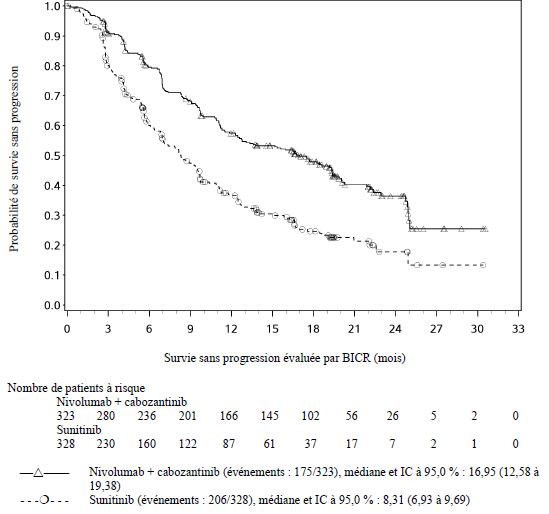
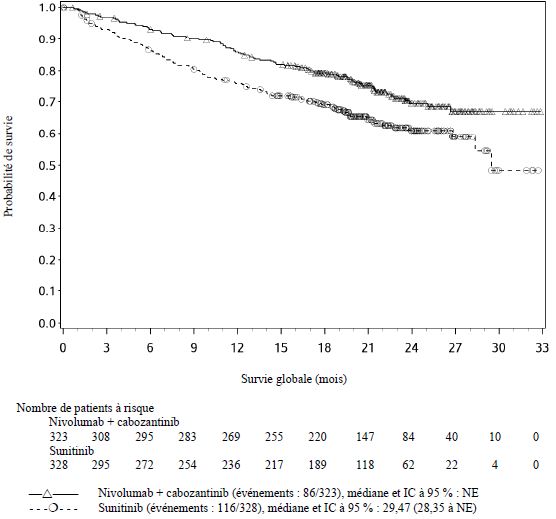
OPDIVO est indiqué en association au cabozantinib, en première ligne, dans le traitement des patients adultes atteints d'un carcinome à cellules rénales avancé (voir rubrique Propriétés pharmacodynamiques).
Lymphome de Hodgkin classique (LHc)
OPDIVO est indiqué en monothérapie dans le traitement des patients adultes atteints d'un lymphome de Hodgkin classique en rechute ou réfractaire après une greffe de cellules souches autologue (GCSA) et un traitement par brentuximab vedotin.
Cancer épidermoïde de la tête et du cou (SCCHN)
OPDIVO est indiqué en monothérapie dans le traitement des patients adultes atteints d'un cancer épidermoïde de la tête et du cou, en rechute ou métastatique, en progression pendant ou après une chimiothérapie à base de sels de platine (voir rubrique Propriétés pharmacodynamiques).
Carcinome urothélial
OPDIVO est indiqué en monothérapie dans le traitement des patients adultes atteints d'un carcinome urothélial localement avancé non résécable ou métastatique après échec d'une chimiothérapie antérieure à base de sels de platine.
Traitement adjuvant du carcinome urothélial
OPDIVO est indiqué en monothérapie dans le traitement adjuvant des patients adultes atteints de
carcinome urothélial infiltrant le muscle (CUIM) à haut risque de récidive après exérèse complète,
dont les cellules tumorales expriment PD-L1 au seuil ≥ 1 % (voir rubrique Propriétés pharmacodynamiques).
Cancer
colorectal (CRC) avec déficience du système de réparation des mésappariements
de l'ADN (dMMR) ou instabilité microsatellitaire
élevée (MSI-H)
OPDIVO est indiqué en association à l'ipilimumab,
dans le traitement des patients adultes atteints d'un cancer colorectal
métastatique avec une déficience du système de réparation des mésappariements
de l'ADN ou une instabilité microsatellitaire élevée
après une association antérieure de chimiothérapie à base de fluoropyrimidine (voir rubrique Propriétés
pharmacodynamiques).
Carcinome épidermoïde de l'œsophage (CEO)
OPDIVO est indiqué en association à l'ipilimumab, en première ligne, dans le traitement des patients
adultes atteints d'un carcinome épidermoïde de l'œsophage avancé non résécable, récurrent ou
métastatique dont les cellules tumorales expriment PD-L1 au seuil ≥ 1 %.
OPDIVO est indiqué en association à une chimiothérapie combinée à base de fluoropyrimidine et de
sels de platine, en première ligne, dans le traitement des patients adultes atteints d'un carcinome
épidermoïde de l'œsophage avancé non résécable, récurrent ou métastatique dont les cellules
tumorales expriment PD-L1 au seuil ≥ 1 %.
OPDIVO est indiqué en monothérapie dans le traitement des patients adultes atteints d'un carcinome épidermoïde de l'œsophage avancé non résécable, récurrent ou métastatique, après une chimiothérapie combinée antérieure à base de fluoropyrimidine et de sels de platine.
Traitement adjuvant du cancer de l'œsophage ou de la jonction oeso-gastrique (CO ou CJOG)
OPDIVO est indiqué en monothérapie dans le traitement adjuvant des patients adultes atteints d'un cancer de l'œsophage ou de la jonction œso-gastrique et qui présentent une maladie résiduelle après une radiochimiothérapie néoadjuvante antérieure (voir rubrique Propriétés pharmacodynamiques).
Adénocarcinome gastrique, de la jonction œso-gastrique (JOG) ou de l'œsophage
OPDIVO est indiqué en association à une chimiothérapie combinée à base de fluoropyrimidine et de sels de platine, en première ligne, dans le traitement des patients adultes atteints d'un adénocarcinome gastrique, de la jonction œso-gastrique ou de l'œsophage avancé ou métastatique, HER-2 négatif, dont les tumeurs expriment PD-L1 avec un score combiné positif (Combined Positive Score : CPS) ≥ 5.
Hypersensibilité au principe actif ou à l'un des excipients mentionnés à la rubrique Liste des excipients.
Traçabilité
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le
numéro de lot du produit administré doivent être clairement enregistrés.
Evaluation
du statut PD-L1
Lors de l'évaluation du statut PD-L1 de la tumeur, il est important de choisir
une méthodologie validée et robuste.
Effets
indésirables d'origine immunologique
Lorsque nivolumab
est administré en association, se référer au RCP des autres agents thérapeutiques
du traitement en association avant l'initiation du traitement. Les effets
indésirables d'origine immunologique sont survenus à des fréquences plus
élevées lorsque nivolumab était administré en
association à l'ipilimumab comparativement à nivolumab
en monothérapie. Les effets indésirables d'origine immunologique sont apparus à
des fréquences similaires lorsqu'OPDIVO était administré en association au cabozantinib
comparé au nivolumab
administré en monothérapie. Par conséquent, les recommandations présentées
ci-dessous concernant les effets indésirables d'origine immunologique
s'appliquent au traitement par OPDIVO dans l'association, sauf en cas de
mention contraire. La plupart des effets indésirables d'origine immunologique
s'est améliorée ou résolue avec une prise en charge appropriée, incluant
l'initiation de corticoïdes et des modifications de traitement (voir rubrique
Posologie et mode d'administration).
Des effets indésirables d'origine immunologique affectant plus d'un système
d'organes peuvent survenir simultanément.
Des effets indésirables cardiaques et pulmonaires, notamment des embolies pulmonaires ont aussi été rapportés avec le traitement en association. Les patients doivent être continuellement surveillés pour des effets indésirables cardiaques et pulmonaires, ainsi que pour des signes cliniques, des symptômes et des anomalies biologiques indiquant des troubles électrolytiques et une déshydratation, avant l'initiation et à intervalles réguliers au cours du traitement. Nivolumab en association à l'ipilimumab doit être arrêté en cas d'effets indésirables sévères cardiaques et pulmonaires récurrents ou pouvant menacer le pronostic vital (voir rubrique Posologie et mode d'administration).
Les patients doivent être continuellement surveillés (au moins jusqu'à 5 mois après la dernière perfusion), un effet indésirable avec nivolumab ou avec nivolumab en association à l'ipilimumab pouvant survenir à tout moment pendant ou après l'arrêt du traitement.
En cas de suspicion d'effets indésirables d'origine immunologique, une évaluation appropriée doit être effectuée afin de confirmer l'étiologie ou d'exclure d'autres causes. Sur la base de la sévérité de l'effet indésirable, le traitement par nivolumab ou par nivolumab en association à l'ipilimumab doit être suspendu, et des corticoïdes administrés. Si une immunosuppression par corticoïdes est utilisée pour traiter un effet indésirable, une décroissance progressive des doses sur une période d'au moins un mois doit être initiée à partir de l'amélioration. Une diminution rapide des doses peut entraîner une aggravation ou une récidive de l'effet indésirable. Des traitements immunosuppresseurs nonstéroïdiens doivent être ajoutés en cas d'aggravation ou d'absence d'amélioration malgré l'utilisation de corticoïdes.
Le traitement par nivolumab ou par nivolumab en association à l'ipilimumab ne doit pas être repris tant que le patient reçoit des doses immunosuppressives de corticoïdes ou d'autres médicaments immunosuppresseurs. Une prophylaxie antibiotique doit être utilisée pour prévenir les infections opportunistes chez les patients recevant des médicaments immunosuppresseurs.
Nivolumab ou nivolumab en association à l'ipilimumab doit être définitivement arrêté en cas d'effet indésirable sévère récurrent d'origine immunologique, et pour tout effet indésirable d'origine immunologique pouvant menacer le pronostic vital.
Pneumopathie
inflammatoire d'origine immunologique
Des pneumopathies inflammatoires ou interstitielles diffuses sévères, dont des
cas d'issue fatale, ont été observées avec nivolumab
en monothérapie ou nivolumab en
association à l'ipilimumab (voir rubrique Effets
indésirables). Les patients doivent être surveillés pour déceler
l'apparition de signes et symptômes de pneumopathie inflammatoire, tels que des
modifications radiologiques (ex : opacités focales en verre dépoli, infiltrats
localisés), dyspnée et hypoxie. Une étiologie infectieuse et toute autre
pathologie liée à la maladie doivent être éliminées.
En cas de pneumopathie inflammatoire de Grade 3 ou 4, nivolumab ou nivolumab en association à l'ipilimumab doit être arrêté définitivement et une corticothérapie à la dose de 2 à 4 mg/kg/jour de méthylprednisolone ou équivalent doit être débutée.
En cas de pneumopathie inflammatoire (symptomatique) de Grade 2, nivolumab ou nivolumab en association à l'ipilimumab doit être suspendu et une corticothérapie à la dose de 1 mg/kg/jour de méthylprednisolone ou équivalent doit être débutée. Après amélioration, nivolumab ou nivolumab en association à l'ipilimumab peut être repris après réduction progressive des corticoïdes. En cas d'aggravation ou d'absence d'amélioration malgré l'initiation d'une corticothérapie, les doses de corticoïdes doivent être augmentées à la dose de 2 à 4 mg/kg/jour de méthylprednisolone ou équivalent, et nivolumab ou nivolumab en association à l'ipilimumab doit être arrêté définitivement.
Colite
d'origine immunologique
Des diarrhées ou des colites sévères ont été observées avec nivolumab
en monothérapie ou nivolumab en
association à l'ipilimumab (voir rubrique Effets
indésirables). Les patients doivent être surveillés pour déceler
l'apparition de diarrhées et d'autres symptômes de colites, tels que des
douleurs abdominales et la présence de mucus ou de sang dans les selles. Une
infection / réactivation du cytomégalovirus (CMV) a été rapportée chez des
patients ayant des colites d'origine immunologique réfractaires aux
corticoïdes. Les étiologies infectieuses et autres des diarrhées doivent être
exclues, par conséquent, des tests de biologie appropriés et des examens
complémentaires doivent être effectués. Si le diagnostic de colite d'origine
immunologique réfractaire aux corticoïdes est confirmé, l'ajout d'un agent
immunosuppresseur alternatif au traitement par corticoïdes ou le remplacement du
traitement par corticoïdes doivent
être envisagés.
En cas de diarrhée ou de colite de Grade 4, nivolumab ou nivolumab en association à l'ipilimumab doit être arrêté définitivement et une corticothérapie à la dose de 1 à 2 mg/kg/jour de méthylprednisolone ou équivalent doit être débutée.
Nivolumab en monothérapie doit être suspendu en cas de diarrhée ou de colite de Grade 3, et une corticothérapie à la dose de 1 à 2 mg/kg/jour de méthylprednisolone ou équivalent doit être débutée. Après amélioration, nivolumab en monothérapie peut être repris après réduction progressive des corticoïdes. En cas d'aggravation ou d'absence d'amélioration malgré l'initiation de corticoïdes, nivolumab en monothérapie doit être définitivement arrêté. L'observation de diarrhée ou colite de Grade 3 avec nivolumab en association à l'ipilimumab nécessite aussi un arrêt définitif du traitement et l'initiation de corticoïdes à la dose de 1 à 2 mg/kg/jour de méthylprednisolone ou équivalent.
En cas de diarrhée ou de colite de Grade 2, nivolumab ou nivolumab en association à l'ipilimumab doit être suspendu. Les diarrhées ou les colites persistantes doivent être traitées par une corticothérapie à la dose de 0,5 à 1 mg/kg/jour de méthylprednisolone ou équivalent. Après amélioration, nivolumab ou nivolumab en association à l'ipilimumab peut être repris après réduction progressive des corticoïdes, si nécessaire. En cas d'aggravation ou d'absence d'amélioration malgré l'initiation d'une corticothérapie, les doses de corticoïdes doivent être augmentées à 1 à 2 mg/kg/jour de méthylprednisolone ou équivalent, et nivolumab ou nivolumab en association à l'ipilimumab doit être arrêté définitivement.
Hépatite
d'origine immunologique
Des hépatites sévères ont été observées avec nivolumab
en monothérapie ou nivolumab en
association à l'ipilimumab (voir rubrique Effets
indésirables). Les patients doivent être surveillés pour déceler
l'apparition de signes et symptômes d'hépatite, tels que des augmentations des
transaminases et de la bilirubine totale. Une étiologie infectieuse et toute
autre pathologie liée à la maladie doivent être éliminées.
En cas d'élévation de Grade 3 ou 4 des transaminases ou de la bilirubine totale, nivolumab ou nivolumab en association à l'ipilimumab doit être arrêté définitivement et une corticothérapie à la dose de 1 à 2 mg/kg/jour de méthylprednisolone ou équivalent doit être débutée.
En cas d'élévation de Grade 2 des transaminases ou de la bilirubine totale, nivolumab ou nivolumab en association à l'ipilimumab doit être suspendu. La persistance de cette élévation des valeurs biologiques doit être prise en charge par une corticothérapie à la dose de 0,5 à 1 mg/kg/jour de méthylprednisolone ou équivalent. Après amélioration, nivolumab ou nivolumab en association à l'ipilimumab peut être repris après réduction progressive des corticoïdes, si nécessaire. En cas d'aggravation ou d'absence d'amélioration malgré l'initiation d'une corticothérapie, les doses de corticoïdes doivent être augmentées à 1 à 2 mg/kg/jour de méthylprednisolone ou équivalent et nivolumab ou nivolumab en association à l'ipilimumab doit être arrêté définitivement.
Néphrite et
dysfonction rénale d'origine immunologique
Des néphrites et des atteintes rénales sévères ont été observées avec le traitement
en monothérapie ou nivolumab en
association à l'ipilimumab (voir rubrique Effets
indésirables). Les patients doivent être surveillés pour déceler
l'apparition de signes et symptômes de néphrite ou d'atteinte rénale. La
plupart des patients ont présenté des augmentations asymptomatiques de la
créatinine sérique. Toute autre étiologie liée à la maladie doit être écartée.
En cas d'élévation de Grade 4 de la créatinine sérique, nivolumab ou nivolumab en association à l'ipilimumab doit être arrêté définitivement et une corticothérapie à la dose de 1 à 2 mg/kg/jour de méthylprednisolone ou équivalent doit être débutée.
En cas d'élévation de Grade 2 ou 3 de la créatinine sérique, nivolumab ou nivolumab en association à l'ipilimumab doit être suspendu et une corticothérapie à la dose de 0,5 à 1 mg/kg/jour de méthylprednisolone ou équivalent doit être débutée. Après amélioration, nivolumab ou nivolumab en association à l'ipilimumab peut être repris après réduction progressive des corticoïdes. En cas d'aggravation ou d'absence d'amélioration malgré la corticothérapie, les doses de corticoïdes doivent être augmentées à 1 à 2 mg/kg/jour de méthylprednisolone ou équivalent, et nivolumab ou nivolumab en association à l'ipilimumab doit être arrêté définitivement.
Endocrinopathies d'origine
immunologique
Des endocrinopathies
sévères, incluant hypothyroïdie, hyperthyroïdie, insuffisance surrénalienne
(incluant l'insuffisance cortico-surrénalienne secondaire), hypophysite
(incluant l'hypopituitarisme), diabète sucré, et acidocétose diabétique ont été
observées avec nivolumab en monothérapie ou nivolumab
en association à l'ipilimumab (voir
rubrique Effets indésirables).
Les patients doivent être surveillés pour déceler l'apparition de signes et symptômes d'endocrinopathie, et d'hyperglycémie et des modifications de la fonction thyroïdienne (au début du traitement, à intervalles réguliers en cours de traitement, et si cliniquement indiqué). Les patients peuvent présenter de la fatigue, des céphalées, des modifications de l'état mental, des douleurs abdominales, un transit intestinal inhabituel, et une hypotension, ou des symptômes non spécifiques qui peuvent ressembler à d'autres causes telles que des métastases cérébrales ou une maladie sous-jacente. A moins qu'une autre étiologie n'ait été identifiée, les signes et symptômes d'endocrinopathie doivent être considérés comme d'origine immunologique.
En cas d'hypothyroïdie symptomatique, nivolumab ou nivolumab en association à l'ipilimumab doit être suspendu, et un traitement substitutif en hormone thyroïdienne doit être débuté, si nécessaire. En cas d'hyperthyroïdie symptomatique, nivolumab ou nivolumab en association à l'ipilimumab doit être suspendu, et un traitement par antithyroïdiens doit être débuté, si nécessaire. Une corticothérapie à la dose de 1 à 2 mg/kg/jour de méthylprednisolone ou équivalent doit également être envisagée, en cas de suspicion d'une inflammation aiguë de la thyroïde. Après amélioration, nivolumab ou nivolumab en association à l'ipilimumab peut être repris après réduction progressive des corticoïdes, si nécessaire.
La surveillance de la fonction thyroïdienne doit être poursuivie afin de s'assurer que le traitement substitutif hormonal approprié est utilisé. Nivolumab ou nivolumab en association à l'ipilimumab doit être arrêté définitivement en cas d'hyperthyroïdie ou d'hypothyroïdie pouvant menacer le pronostic vital.
En cas d'insuffisance surrénalienne symptomatique de Grade 2, nivolumab ou nivolumab en association à l'ipilimumab doit être suspendu, et une corticothérapie substitutive à une dose physiologique doit être débutée, si nécessaire. Nivolumab ou nivolumab en association à l'ipilimumab doit être arrêté définitivement en cas d'insuffisance surrénalienne sévère (Grade 3) ou pouvant menacer le pronostic vital (Grade 4). La surveillance de la fonction surrénalienne et des taux d'hormone doit être poursuivie afin de s'assurer que la corticothérapie substitutive appropriée est utilisée.
En cas d'hypophysite symptomatique de Grade 2 ou 3, nivolumab ou nivolumab en association à l'ipilimumab doit être suspendu, et un traitement substitutif hormonal doit être débuté, si nécessaire. En cas de suspicion d'inflammation aiguë de la glande pituitaire, une corticothérapie à la dose de 1 à 2 mg/kg/jour de méthylprednisolone ou équivalent doit également être envisagée. Après amélioration, nivolumab ou nivolumab en association à l'ipilimumab peut être repris après réduction progressive des corticoïdes, si nécessaire. Nivolumab ou nivolumab en association à l'ipilimumab doit être arrêté définitivement en cas d'hypophysite pouvant menacer le pronostic vital (Grade 4). La surveillance de la fonction pituitaire et des taux d'hormone doit être poursuivie afin de s'assurer que le traitement substitutif hormonal approprié est utilisé.
En cas de diabète symptomatique, nivolumab ou nivolumab en association à l'ipilimumab doit être suspendu, et un traitement substitutif par insuline doit être débuté, si nécessaire. La surveillance de la glycémie doit être poursuivie afin d'assurer que le traitement substitutif par insuline approprié est utilisé. Nivolumab ou nivolumab en association à l'ipilimumab doit être arrêté définitivement en cas de diabète pouvant menacer le pronostic vital.
Effets indésirables
cutanés d'origine immunologique
Des éruptions cutanées sévères ont été observées avec nivolumab
en association à l'ipilimumab et,
moins fréquemment, avec nivolumab en
monothérapie (voir rubrique Effets indésirables). Nivolumab
ou nivolumab
en association à l'ipilimumab doit
être suspendu en cas d'éruption cutanée de Grade 3, et il doit être arrêté
définitivement en cas d'éruption cutanée de Grade 4. Les éruptions cutanées
sévères doivent être prises en charge avec de hautes doses de corticoïdes, de 1
à 2 mg/kg/jour de méthylprednisolone ou équivalent.
De rares cas de SJS et de NET, dont certains d'issue fatale, ont été observés. En cas d'apparition de signes ou symptômes de SJS ou de NET, le traitement par nivolumab ou par nivolumab en association à l'ipilimumab doit être interrompu et le patient adressé à un service spécialisé pour évaluation et traitement. Si le patient a développé un SJS ou une NET lors de l'utilisation de nivolumab ou de nivolumab en association à l'ipilimumab, l'arrêt définitif du traitement est recommandé (voir rubriquePosologie et mode d'administration).
L'utilisation de nivolumab doit être considérée avec précaution chez un patient ayant présenté un effet indésirable cutané sévère ou ayant menacé le pronostic vital lors d'un précédent traitement anticancéreux stimulant l'immunité.
Autres
effets indésirables d'origine immunologique
Les effets indésirables d'origine immunologique suivants ont été rapportés chez
moins de 1% des patients traités par nivolumab en
monothérapie ou par nivolumab en
association à l'ipilimumab dans les essais cliniques
avec différentes doses et dans différents types de tumeurs : pancréatite,
uvéite, démyélinisation, neuropathie auto-immune (incluant parésie des nerfs
facial et abducens),
syndrome de Guillain-Barré, myasthénie grave, syndrome myasthénique,
méningite aseptique, encéphalite, gastrite, sarcoïdose, duodénite, myosite,
myocardite et rhabdomyolyse. Des cas de syndrome de Vogt-Koyanagi-Harada, d'hypoparathyroïdie et de
cystite non infectieuse ont été rapportés après commercialisation (voir
rubriques Posologie et mode d'administration et Effets indésirables).
En cas de suspicion d'effet indésirable d'origine immunologique, une évaluation appropriée doit être effectuée afin de confirmer l'étiologie ou d'exclure d'autres causes. En fonction de la gravité de l'effet indésirable, le traitement par nivolumab ou par nivolumab en association à l'ipilimumab doit être suspendu et des corticoïdes doivent être administrés. Après amélioration, nivolumab ou nivolumab en association à l'ipilimumab peut être repris après réduction progressive des corticoïdes. Nivolumab ou nivolumab en association à l'ipilimumab doit être arrêté définitivement en cas d'effet indésirable sévère récurrent d'origine immunologique, et pour tout effet indésirable d'origine immunologique pouvant menacer le pronostic vital.
Des cas de myotoxicité
(myosite, myocardite et rhabdomyolyse), dont certains d'issue fatale, ont été
rapportés avec nivolumab ou nivolumab
en association à l'ipilimumab. Si un
patient développe des signes et symptômes de myotoxicité,
une surveillance étroite doit être mise en place et le patient doit être
adressé à un spécialiste pour évaluation et traitement sans délai. Sur la base
de la sévérité de la myotoxicité, nivolumab
ou nivolumab
en association à l'ipilimumab doit
être suspendu ou arrêté (voir rubrique Posologie et mode d'administration),
et un traitement approprié instauré.
Le diagnostic de myocardite exige un haut degré de suspicion. Les patients
présentant des symptômes cardiaques ou cardio-pulmonaires doivent être évalués
pour une myocardite potentielle. Si une myocardite est suspectée,
l'administration immédiate d'une dose élevée de stéroïdes (prednisone 1 à 2
mg/kg/jour ou méthylprednisolone 1 à 2 mg/kg/jour)
et une consultation immédiate en cardiologie avec un bilan diagnostique, selon
les directives cliniques actuelles, doivent être initiées. Une fois qu'un
diagnostic de myocardite est établi, le traitement par nivolumab
ou par nivolumab
en association à l'ipilimumab doit
être suspendu ou définitivement interrompu (voir rubrique Posologie et mode
d'administration).
Un rejet de greffe d'organe solide a été signalé après la mise sur le marché chez des patients traités par inhibiteurs du PD-1. Le traitement par nivolumab peut augmenter le risque de rejet chez les bénéficiaires d'une greffe d'organe solide. Il convient de prendre en considération le rapport entre les bénéfices du traitement par nivolumab et le risque de rejet d'organe chez ces patients.
Des cas de lymphohistiocytose hémophagocytaire (LHH) ont été observés avec le nivolumab en monothérapie et nivolumab en association à l'ipilimumab. L'administration de nivolumab en monothérapie ou en association à l'ipilimumab doit être faite avec précaution. Si une LHH est confirmée, l'administration de nivolumab en monothérapie ou en association à l'ipilimumab doit être interrompue et un traitement contre la LHH doit être instauré.
Réactions à
la perfusion
Des réactions sévères liées à la perfusion ont été rapportées dans les essais
cliniques de nivolumab ou de nivolumab
en association à l'ipilimumab (voir
rubrique Effets indésirables). En cas de réaction sévère à la perfusion
ou pouvant menacer le pronostic vital, la perfusion de nivolumab
ou de nivolumab
en association à l'ipilimumab doit
être arrêtée et un traitement médical approprié doit être administré. Les
patients présentant une réaction à la perfusion d'intensité légère à modérée
peuvent recevoir nivolumab ou nivolumab
en association à l'ipilimumab sous
surveillance étroite et avec l'utilisation d'uneprémédication
suivant les recommandations locales de traitement pour la prophylaxie des
réactions liées à la perfusion.
Précautions spécifiques à la maladie
Mélanome
avancé
Les patients présentant un score de performance initial ≥ 2, des
métastases cérébrales actives ou des métastases leptoméningées,
une maladie auto-immune, ainsi que les patients qui avaient reçu un traitement
immunosuppresseur par voie systémique avant l'entrée dans l'étude ont été exclus
des études cliniques pivots de nivolumab ou de nivolumab
en association à l'ipilimumab (voir
rubriques Interactions avec d'autres médicaments et autres formes
d'interactions et Propriétés pharmacodynamiques). Les patients ayant
un mélanome oculaire/uvéal ont été exclus des études cliniques conduites dans
le mélanome. De plus, les patients ayant eu un effet indésirable de Grade 4 lié
à un traitement par anti-CTLA-4 ont été exclus de l'étude CA209037 (voir
rubrique Propriétés pharmacodynamiques). Les patients ayant un score de
performance initial de 2, des métastases leptoméningées
traitées, un mélanome oculaire/uvéal, une maladie auto-immune et les patients
ayant eu un effet indésirable de Grade 3 ou 4 lié à un traitement antérieur par
anti-CTLA-4 ont été inclus dans l'étude CA209172 (voir rubrique Propriétés
pharmacodynamiques). En l'absence de données chez les patients ayant reçu
des immunosuppresseurs par voie systémique avant leur participation à l'étude
et chez les patients présentant des métastases cérébrales actives ou des
métastases leptoméningées,
le nivolumab
doit être utilisé avec précaution dans ces populations, après évaluation
attentive du bénéfice/risque potentiel au cas par cas.
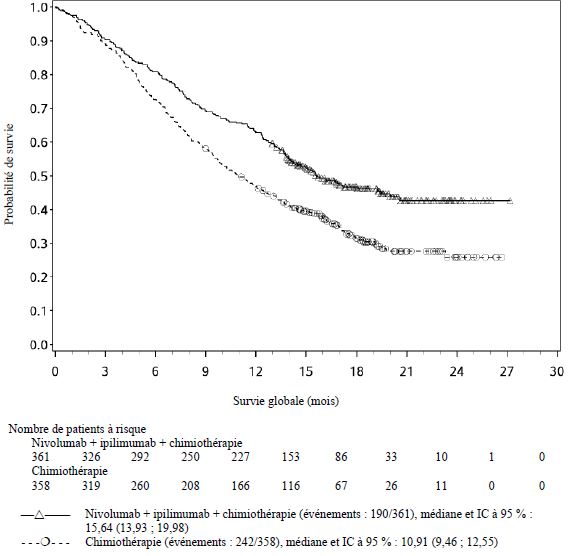
Par rapport à nivolumab en monothérapie, une augmentation de la SSP pour l'association de nivolumab à l'ipilimumab a été établie uniquement chez les patients avec une expression tumorale faible de PD-L1. L'amélioration de la SG était similaire entre nivolumab en association à l'ipilimumab et nivolumab en monothérapie chez les patients avec une expression tumorale élevée de PD-L1 (PD- L1 ≥ 1 %). Avant l'initiation du traitement avec l'association, les médecins sont invités à évaluer avec précaution les caractéristiques individuelles du patient et de la tumeur, en prenant en considération les bénéfices observés et la toxicité de l'association par rapport à nivolumab en monothérapie (voir rubriques Effets indésirables et Propriétés pharmacodynamiques).
Utilisation
de nivolumab
chez les patients atteints de mélanome rapidement progressif
Les médecins doivent prendre en considération l'apparition retardée de l'effet
de nivolumab
avant d'initier le traitement chez les patients présentant une maladie
rapidement progressive (voir rubrique Propriétés pharmacodynamiques).
Traitement
adjuvant du mélanome
Aucune donnée n'est disponible sur le traitement adjuvant chez des patients
atteints de mélanome présentant les facteurs de risque suivants (voir rubriques
Interactions avec d'autres médicaments et autres formes d'interactions
et Propriétés pharmacodynamiques) :
● patients ayant des antécédents de maladie
auto-immune, et toute maladie nécessitant un traitement systémique par
corticoïdes (≥ 10 mg de prednisone ou équivalent par jour) ou autre
médicament immunosuppresseur,
● patients ayant déjà été traités pour un mélanome (à
l'exception de patients ayant subi une intervention chirurgicale, ayant reçu
une radiothérapie adjuvante après une résection neurochirurgicale de lésions du
système nerveux central et ayant terminé un traitement adjuvant antérieur par
interféron ≥ 6 mois avant la randomisation),
● patients ayant reçu un traitement par anticorps
anti-PD-1, anti-PD-L1, anti-PD-L2, anti-CD137 ou anti CTLA-4 (notamment l'ipilimumab
ou tout autre anticorps ou médicament ciblant spécifiquement la co-stimulation
ou les points de contrôle immunitaires des lymphocytes T),
● sujets de moins de 18 ans.
En l'absence de données, le nivolumab doit être
utilisé avec précaution dans ces populations, après évaluation attentive du
bénéfice/risque potentiel au cas par cas.
Cancer
bronchique non à petites cellules
Traitement de première ligne du CBNPC
Les patients présentant une maladie auto-immune active, une pneumopathie
interstitielle diffuse symptomatique, des conditions médicales nécessitant une
immunosuppression systémique, des métastases cérébrales actives (non traitées),
qui ont reçu un traitement systémique préalable pour une maladie avancée, ou
qui présentent des mutations sensibilisantes de l'EGFR ou des translocations
ALK, ont été exclus de l'étude pivot conduite en première ligne du traitement
du CBNPC (voir rubriques Interactions avec d'autres médicaments et autres
formes d'interactions et Propriétés pharmacodynamiques). Les données
disponibles chez les patients âgées (≥ 75 ans) sont limitées (voir
rubrique Propriétés pharmacodynamiques). Chez ces patients, nivolumab
en association à l'ipilimumab et à une
chimiothérapie doit être utilisé avec précaution après évaluation attentive du
bénéfice/risque potentiel au cas par cas.
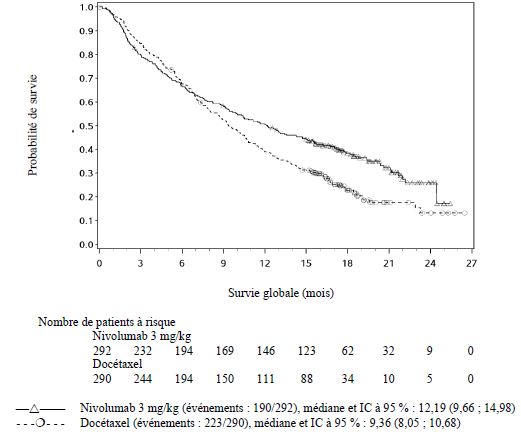
Traitement
du CBNPC après chimiothérapie antérieure
Les patients présentant un score de performance initial ≥ 2, des
métastases cérébrales actives, une pneumopathie interstitielle diffuse
symptomatique ou une maladie auto-immune, ainsi que les patients qui avaient
reçu au préalable un traitement immunosuppresseur par voie systémique ont été
exclus des études cliniques pivots conduites dans le CBNPC (voir rubriques Interactions
avec d'autres médicaments et autres formes d'interactions et Propriétés pharmacodynamiques).
Les patients avec un score de performance initial de 2 ont été inclus dans
l'étude CA209171 (voir rubrique Propriétés pharmacodynamiques). En
l'absence de données chez les patients atteints d'une maladie auto-immune,
d'une pneumopathie interstitielle diffuse symptomatique, de métastases
cérébrales actives et chez les patients ayant reçu des immunosuppresseurs par
voie systémique avant leur participation à l'étude, nivolumab
doit être utilisé avec précaution dans ces populations, après évaluation
attentive du bénéfice/risque potentiel au cas par cas.
Les médecins doivent prendre en considération l'apparition retardée de l'effet
de nivolumab
avant d'initier le traitement chez les patients présentant des caractéristiques
de moins bon pronostic et/ou une maladie agressive. Dans le CBNPC de type
non-épidermoïde, un plus grand nombre de décès dans les 3 premiers mois de
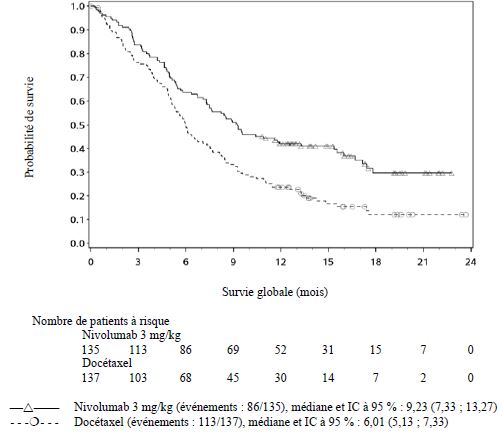
traitement a été observé sous nivolumab comparé
au docétaxel.
Les facteurs associés aux décès précoces étaient des facteurs de moins bon
pronostic et/ou des maladies plus agressives associés à une absence ou à une
expression tumorale faible de PD-L1 (voir rubrique Propriétés
pharmacodynamiques).
Traitement néoadjuvant du CBNPC
Les patients présentant un score de performance initial ≥ 2, une maladie auto-immune active, une
pneumopathie interstitielle diffuse symptomatique, des conditions médicales nécessitant une
immunosuppression systémique, une maladie non résécable ou métastatique, qui ont reçu un
traitement anticancéreux antérieur pour une maladie résécable ou qui présentaient des mutations
connues de l’EGFR ou des translocations connues ALK ont été exclus de l’étude pivot dans le
traitement néoadjuvant du CBNPC résécable (voir rubrique Propriétés pharmacodynamiques). En l’absence de données, le
nivolumab en association à une chimiothérapie doit être utilisé avec précaution dans ces populations,
après évaluation attentive du bénéfice/risque potentiel au cas par cas.
Mésothéliome pleural malin
Les patients présentant un mésothéliome primitif
péritonéal, péricardique, des testicules ou de la tunique vaginale, une
pneumopathie interstitielle diffuse, une maladie auto-immune active,
des conditions
médicales nécessitant une immunosuppression systémique, et des
métastases
cérébrales (à moins d'une résection chirurgicale ou d'une radiothérapie
stéréotaxique, et sans évolution dans les 3 mois précédant l'inclusion
dans
l'étude) ont été exclus de l'étude pivot dans le traitement de première
ligne
du MPM (voir rubriques Interactions avec d'autres médicaments et autres
formes d'interactions et Propriétés pharmacodynamiques). En
l'absence de données, nivolumab en association à l'ipilimumab doit être utilisé avec précaution dans ces
populations, après évaluation attentive du bénéfice/risque potentiel au cas par
cas.
Carcinome
à cellules rénales
Nivolumab
ou nivolumab
en association à ipilimumab
Les patients présentant des antécédents de métastases cérébrales, une
maladie auto-immune
active, ou des conditions médicales nécessitant une immunosuppression systémique
ont été exclus des essais cliniques portant sur nivolumab
en monothérapie ou nivolumab en
association à l'ipilimumab (voir rubriques Interactions
avec d'autres médicaments et autres formes d'interactions et Propriétés
pharmacodynamiques). En l'absence de données, le nivolumab
ou le nivolumab
en association à l'ipilimumab doivent
être utilisés avec précaution dans ces populations, après évaluation attentive
du bénéfice/risque potentiel au cas par cas.
Nivolumab en association au cabozantinib
Les patients présentant des métastases cérébrales actives, une maladie
auto-immune, ou des conditions médicales nécessitant une immunosuppression
systémique ont été exclus des essais cliniques portant sur le nivolumab
en association au cabozantinib (voir rubriques Interactions
avec d'autres médicaments et autres formes d'interactions et Propriétés
pharmacodynamiques). En l'absence de données, nivolumab
en association au cabozantinib doit être utilisé avec
précaution dans ces populations, après évaluation attentive du bénéfice/risque
potentiel au cas par cas.
Lorsque nivolumab est administré en association au cabozantinib, des fréquences plus élevées d'augmentations des taux d'ALAT et d'ASAT de Grades 3 et 4 ont été rapportées comparé au nivolumab administré en monothérapie chez les patients atteints de CCR avancé (voir rubrique Effets indésirables). Les enzymes hépatiques doivent être surveillées avant l'initiation du traitement et de façon régulière pendant le traitement. Les recommandations de surveillance médicale pour les deux médicaments doivent être respectées (voir rubrique Posologie et mode d'administration et se référer au RCP du cabozantinib).
Lymphome de
Hodgkin classique (LHc)
Les patients présentant une maladie auto-immune active et une pneumopathie
interstitielle diffuse symptomatique ont été exclus des essais cliniques dans
le LHc
(voir rubrique Propriétés pharmacodynamiques). En l'absence de données, nivolumab
doit être utilisé avec précaution dans ces populations, après évaluation
attentive du bénéfice/risque potentiel au cas par cas.
Complications
d'une greffe allogénique de cellules souches
hématopoïétiques (GCSH) dans le lymphome de Hodgkin classique
Des cas de réaction aiguë du greffon contre l'hôte (GVHD : Graft
Versus Host Disease), et de mortalité liée à la
transplantation (MLT) ont été observés durant le suivi des patients atteints de
LHc ayant reçu une GCSH allogénique
après une exposition antérieure au nivolumab. Une
prise en compte attentive des bénéfices potentiels d'une GCSH et d'une possible
augmentation du risque de complications liées à la greffe devra être effectuée
au cas par cas (voir rubrique Effets indésirables).
Chez les patients traités par nivolumab après une GCSH allogénique, des cas sévères et d'apparition rapide de GVHD, dont certains d'issue fatale, ont été rapportés après commercialisation. Le traitement par nivolumab peut augmenter le risque de GVHD sévère et de décès chez les patients ayant eu une GCSH allogénique antérieure, principalement chez ceux ayant un antécédent de GVHD. Le bénéfice du traitement par nivolumab par rapport au risque potentiel doit être pris en considération chez ces patients (voir rubrique Effets indésirables).
Cancer de
la tête et du cou
Les patients ayant un score de performance initial ≥ 2, des métastases
cérébrales ou leptoméningées actives, une maladie
auto-immune active, un contexte médical nécessitant une immunosuppression par
voie systémique, ou un carcinome du nasopharynx ou des glandes salivaires comme
localisation primitive de la tumeur, ont été exclus de l'essai clinique conduit
dans le SCCHN (voir rubriques Interactions avec d'autres médicaments et
autres formes d'interactions et Propriétés pharmacodynamiques). En
l'absence de données, le nivolumab doit être
utilisé avec précaution dans ces populations, après évaluation attentive du
bénéfice/risque potentiel au cas par cas.
Les médecins doivent prendre en considération l'apparition retardée de l'effet de nivolumab avant d'initier le traitement chez les patients présentant des caractéristiques de moins bon pronostic et/ou une maladie agressive. Dans le cancer de la tête et du cou, un plus grand nombre de décès dans les 3 premiers mois de traitement a été observé sous nivolumab comparé au docétaxel. Les facteurs associés aux décès précoces étaient le statut de performance ECOG, la progression rapide de la maladie sous une thérapie antérieure à base de sels de platine et une masse tumorale élevée.
Carcinome urothélial
Traitement du carcinome urothélial avancé
Les patients ayant un score de performance initial ≥ 2, des métastases
cérébrales actives ou des métastases leptoméningées, une
maladie auto-immune active ou un contexte médical nécessitant une
immunosuppression par voie systémique, ont été exclus des essais cliniques
conduits dans le carcinome urothélial (voir
rubriques Interactions avec d'autres médicaments et autres formes
d'interactions et Propriétés pharmacodynamiques). En l'absence de
données, le nivolumab doit être utilisé avec
précaution dans ces populations, après évaluation attentive du bénéfice/risque
potentiel au cas par cas.
Traitement adjuvant du carcinome urothélial
Les patients ayant un score de performance initial ≥ 2 (excepté les patients avec un score de performance initial de 2 n'ayant pas reçu de chimiothérapie néoadjuvante à base de cisplatine et considérés comme inéligibles à une chimiothérapie adjuvante de cisplatine), une preuve de la maladie 19 après chirurgie, une maladie auto-immune active ou un contexte médical nécessitant une immunosuppression par voie systémique, ont été exclus de l'essai clinique évaluant le traitement adjuvant du carcinome urothélial (voir rubriques Interactions avec d'autres médicaments et autres formes d'interactions et Propriétés pharmacodynamiques). En l'absence de données, le nivolumab doit être utilisé avec précaution dans ces populations, après évaluation attentive du bénéfice/risque potentiel au cas par cas.
Cancer colorectal dMMR ou MSI-H
Les patients présentant un score de performance initial ≥ 2, des métastases cérébrales actives ou des métastases leptoméningées, une maladie auto-immune active, ou un contexte médical nécessitant une immunosuppression par voie systémique ont été exclus de l'essai clinique dans le cancer colorectal métastatique dMMR ou MSI-H (voir rubriques Interactions avec d'autres médicaments et autres formes d'interactions et Propriétés pharmacodynamiques). En l'absence de données, le nivolumab en association à l'ipilimumab doit être utilisé avec précaution dans ces populations, après évaluation attentive du bénéfice/risque potentiel au cas par cas.
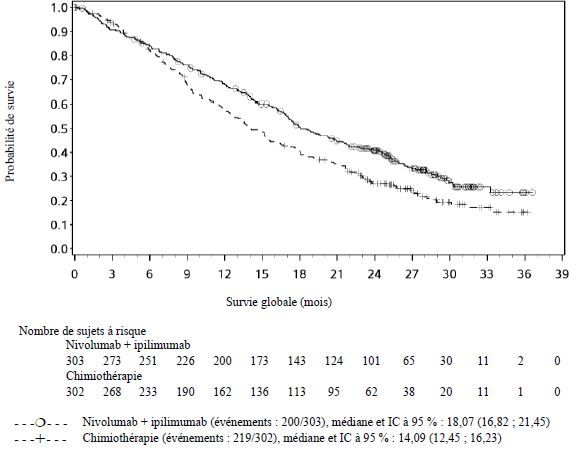
Carcinome épidermoïde de l'œsophage
Traitement en première ligne du CEO
Les patients présentant un score de performance initial ≥ 2, des antécédents de métastases cérébrales, une maladie auto-immune active, un contexte médical nécessitant une immunosuppression par voie systémique, ou à haut risque de saignements ou de fistule due à une invasion tumorale apparente dans les organes adjacents à la tumeur œsophagienne ont été exclus de l'essai clinique évaluant le CEO (voir rubriques Interactions avec d'autres médicaments et autres formes d'interactions et Propriétés pharmacodynamiques). En l'absence de données, le nivolumab en association à l'ipilimumab ou à une chimiothérapie doit être utilisé avec précaution dans ces populations, après évaluation attentive du bénéfice/risque potentiel au cas par cas.
Dans l'essai clinique en première ligne du CEO, un nombre plus élevé de décès a été observé dans les 4 premiers mois avec le nivolumab en association à l'ipilimumab comparé à la chimiothérapie. Les médecins doivent prendre en considération l'apparition retardée de l'effet du nivolumab en association à l'ipilimumab avant d'initier le traitement chez les patients présentant des caractéristiques de moins bon pronostic et/ou une maladie agressive (voir rubrique Propriétés pharmacodynamiques).
Traitement du CEO après une première ligne de traitement par chimiothérapie
La majorité des données cliniques disponibles dans le carcinome épidermoïde de l'œsophage concernent des patients d'origine asiatique (voir rubrique Propriétés pharmacodynamiques).
Les patients ayant un score de performance initial ≥ 2, des métastases cérébrales symptomatiques ou nécessitant un traitement, une invasion tumorale apparente dans les organes situés à proximité de l'œsophage, (par exemple l'aorte ou les voies respiratoires), une maladie auto-immune active, ou un contexte médical nécessitant une immunosuppression par voie systémique ont été exclus de l'essai clinique conduit dans le CEO (voir rubriques Interactions avec d'autres médicaments et autres formes d'interactions et Propriétés pharmacodynamiques). En l'absence de données, le nivolumab doit être utilisé avec précaution dans ces populations, après évaluation attentive du bénéfice/risque potentiel au cas par cas.
Les médecins doivent prendre en considération l'apparition retardée de l'effet de nivolumab avant d'initier le traitement chez les patients avec un CEO. Un nombre plus élevé de décès a été observé dans les 2,5 mois après la randomisation avec nivolumab comparé à la chimiothérapie. Aucun facteur spécifique associé à ces décès précoces n'a pu être identifié (voir rubrique Propriétés pharmacodynamiques).
Les patients ayant un score de performance initial ≥ 2 (excepté les patients avec un score de performance initial de 2 n'ayant pas reçu de chimiothérapie néoadjuvante à base de cisplatine et considérés comme inéligibles à une chimiothérapie adjuvante de cisplatine), une preuve de la maladie 19 après chirurgie, une maladie auto-immune active ou un contexte médical nécessitant une immunosuppression par voie systémique, ont été exclus de l'essai clinique évaluant le traitement adjuvant du carcinome urothélial (voir rubriques Interactions avec d'autres médicaments et autres formes d'interactions et Propriétés pharmacodynamiques). En l'absence de données, le nivolumab doit être utilisé avec précaution dans ces populations, après évaluation attentive du bénéfice/risque potentiel au cas par cas.
Cancer colorectal dMMR ou MSI-H
Les patients présentant un score de performance initial ≥ 2, des métastases cérébrales actives ou des métastases leptoméningées, une maladie auto-immune active, ou un contexte médical nécessitant une immunosuppression par voie systémique ont été exclus de l'essai clinique dans le cancer colorectal métastatique dMMR ou MSI-H (voir rubriques Interactions avec d'autres médicaments et autres formes d'interactions et Propriétés pharmacodynamiques). En l'absence de données, le nivolumab en association à l'ipilimumab doit être utilisé avec précaution dans ces populations, après évaluation attentive du bénéfice/risque potentiel au cas par cas.
Carcinome épidermoïde de l'œsophage
Traitement en première ligne du CEO
Les patients présentant un score de performance initial ≥ 2, des antécédents de métastases cérébrales, une maladie auto-immune active, un contexte médical nécessitant une immunosuppression par voie systémique, ou à haut risque de saignements ou de fistule due à une invasion tumorale apparente dans les organes adjacents à la tumeur œsophagienne ont été exclus de l'essai clinique évaluant le CEO (voir rubriques Interactions avec d'autres médicaments et autres formes d'interactions et Propriétés pharmacodynamiques). En l'absence de données, le nivolumab en association à l'ipilimumab ou à une chimiothérapie doit être utilisé avec précaution dans ces populations, après évaluation attentive du bénéfice/risque potentiel au cas par cas.
Dans l'essai clinique en première ligne du CEO, un nombre plus élevé de décès a été observé dans les 4 premiers mois avec le nivolumab en association à l'ipilimumab comparé à la chimiothérapie. Les médecins doivent prendre en considération l'apparition retardée de l'effet du nivolumab en association à l'ipilimumab avant d'initier le traitement chez les patients présentant des caractéristiques de moins bon pronostic et/ou une maladie agressive (voir rubrique Propriétés pharmacodynamiques).
Traitement du CEO après une première ligne de traitement par chimiothérapie
La majorité des données cliniques disponibles dans le carcinome épidermoïde de l'œsophage concernent des patients d'origine asiatique (voir rubrique Propriétés pharmacodynamiques).
Les patients ayant un score de performance initial ≥ 2, des métastases cérébrales symptomatiques ou nécessitant un traitement, une invasion tumorale apparente dans les organes situés à proximité de l'œsophage, (par exemple l'aorte ou les voies respiratoires), une maladie auto-immune active, ou un contexte médical nécessitant une immunosuppression par voie systémique ont été exclus de l'essai clinique conduit dans le CEO (voir rubriques Interactions avec d'autres médicaments et autres formes d'interactions et Propriétés pharmacodynamiques). En l'absence de données, le nivolumab doit être utilisé avec précaution dans ces populations, après évaluation attentive du bénéfice/risque potentiel au cas par cas.
Les médecins doivent prendre en considération l'apparition retardée de l'effet de nivolumab avant d'initier le traitement chez les patients avec un CEO. Un nombre plus élevé de décès a été observé dans les 2,5 mois après la randomisation avec nivolumab comparé à la chimiothérapie. Aucun facteur spécifique associé à ces décès précoces n'a pu être identifié (voir rubrique Propriétés pharmacodynamiques).
Traitement
adjuvant du cancer de l'œsophage ou de la jonction œso-gastrique
Les patients ayant un score de performance initial ≥ 2, n'ayant pas reçu
de radiochimiothérapie (RCT) concomitante avant la
chirurgie, avec tumeur résécable de stade IV, une
maladie auto-immune active ou un contexte médical nécessitant une
immunosuppression par voie systémique ont été exclus de l'essai clinique
conduit dans le cancer de l'œsophage et de la jonction œso-gastrique (voir rubriques Interactions
avec d'autres médicaments et autres formes d'interactions et Propriétés
pharmacodynamiques). En l'absence de données, le nivolumab
doit être utilisé avec précaution dans ces populations, après évaluation
attentive du bénéfice/risque potentiel au cas par cas.
Adénocarcinome
gastrique, de la jonction œso-gastrique ou de
l'œsophage
Les patients ayant un score de performance ECOG initial ≥ 2, des
métastases du système nerveux central non traitées, une maladie auto-immune
active, connue ou suspectée ou un contexte médical nécessitant une
immunosuppression par voie systémique ont été exclus de l'essai clinique
conduit dans l'adénocarcinome gastrique, de la JOG ou de l'œsophage (voir
rubriques Interactions avec d'autres médicaments et autres formes
d'interactions et Propriétés pharmacodynamiques). En l'absence de
données, le nivolumab en association à une
chimiothérapie doit être utilisé avec précaution dans ces populations, après
évaluation attentive du bénéfice/risque au cas par cas.
Les patients avec un statut HER2-positif connu ont été exclus de l'étude
CA209649. Les patients avec un statut indéterminé ont été inclus dans l'étude
et ont représenté 40,3 % des patients (voir rubrique Propriétés pharmacodynamiques).
Patients
sous régime hyposodé contrôlé
Chaque
mL de ce médicament contient 0,1 mmol (ou 2,5 mg) de sodium. Ce
médicament contient 10 mg de sodium par flacon de 4 mL, 25 mg de sodium
par flacon de 10 mL, 30 mg de sodium par flacon de 12 mL ou 60 mg de
sodium par flacon de 24 mL, ce qui équivaut à 0,5 %, 1,25 %, 1,5 % ou 3
% respectivement, de l'apport quotidien maximal recommandé par l'OMS de
2 g de sodium pour un adulte.
Carte
d'alerte patient
Tous les prescripteurs d'OPDIVO doivent connaître l'information destinée aux
médecins et les recommandations de prise en charge. Le prescripteur doit
discuter avec le patient des risques liés au traitement par OPDIVO. Le patient
recevra à chaque prescription la carte d'alerte patient.
Nivolumab en monothérapie (voir rubrique Posologie et mode d'administration)
Résumé
du profil de sécurité
Dans
l'ensemble des données poolées de nivolumab en monothérapie dans
différents types de tumeur
(n = 4 646) avec un suivi minimum de 2,3 à 28 mois, les effets
indésirables les plus fréquents (≥ 10 %
des patients) ont été : fatigue (44 %), douleur musculo-squelettique
(28 %), diarrhée (26 %), éruption cutanée (24 %), toux (22 %), nausée
(22 %), prurit (19 %), diminution de l’appétit (17 %), arthralgie
(17 %), constipation (16 %), dyspnée (16 %), douleurs abdominales (15
%), infection des voies
aériennes supérieures (15 %), fièvre (13 %), céphalée (13 %), anémie
(13 %) et vomissements (12 %).
La majorité des effets indésirables était d'intensité légère à modérée
(Grade 1 ou 2). L’incidence des
effets indésirables de Grades 3 à 5 était de 44 %, dont 0,3 % de cas
d’effets indésirables d’issue fatale
attribués au traitement à l’étude. Avec un suivi minimum de 63 mois
dans le CBNPC, aucun nouveau
signal de sécurité n’a été identifié.
Liste tabulée des effets indésirables
Les effets indésirables rapportés dans l'ensemble des données poolées pour les
patients traités par nivolumab en monothérapie (n = 4 646) sont présentés dans
le Tableau 6. Ces effets sont présentés par classe de systèmes d'organes et par
ordre de fréquence. Les fréquences sont définies comme suit : très fréquent (≥
1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000,
< 1/100) ; rare (≥ 1/10 000, < 1/1 000) ; très rare (< 1/10 000)
; fréquence indéterminée (ne peut être estimée sur la base des données
post-commercialisation disponibles). Au sein de chaque groupe de fréquence, les
effets indésirables sont présentés suivant un ordre de gravité décroissant.
Tableau 6 : Effets indésirables du nivolumab en monothérapie
| Nivolumab en monothérapie | |
| Infections et infestations | |
| Très fréquent | infection des voies aériennes supérieures |
| Fréquent | pneumoniea, bronchite |
| Rare | méningite aseptique |
| Tumeurs bénignes, malignes et non précisées (y compris kystes et polypes) | |
| Rare | lymphadénite histiocytique nécrosante (lymphadénite de Kikuchi) |
| Affections hématologiques et du système lymphatique | |
| Très fréquent | lymphopénieb , anémieb,i, leucopénieb , neutropéniea,b, thrombopénieb |
| Peu fréquent | éosinophilie |
| Fréquence indéterminée | lymphohistiocytose hémophagocytaire |
| Affections du système immunitaire | |
| Fréquent | réaction liée à la perfusion (incluant syndrome de libération de cytokine), hypersensibilité (incluant réaction anaphylactique) |
| Peu fréquent | sarcoïdose |
| Fréquence indéterminée | rejet de greffe d'organe solidef |
| Affections endocriniennes | |
| Fréquent | hypothyroïdie, hyperthyroïdie, thyroïdite |
| Peu fréquent | insuffisance surrénaliennej, hypopituitarisme, hypophysite, diabète sucré |
| Rare | acidocétose diabétique, hypoparathyroïdie |
| Troubles du métabolisme et de la nutrition | |
| Très fréquent | diminution de l'appétit, hyperglycémieb |
| Fréquent | déshydratation, perte de poids, hypoglycémieb |
| Peu fréquent | acidose métabolique |
| Fréquence indéterminée | syndrome de lyse tumoraleg |
| Affections du système nerveux | |
| Très fréquent | céphalée |
| Fréquent | neuropathie périphérique, sensation vertigineuse |
| Peu fréquent | polyneuropathie, neuropathie auto-immune (incluant parésie des nerfs facial et abducens) |
| Rare | syndrome de Guillain-Barré, démyélinisation, syndrome myasthénique, encéphalitea,k |
| Affections oculaires | |
| Fréquent | vision trouble, sécheresse oculaire |
| Peu fréquent | uvéite |
| Fréquence indéterminée | syndrome de Vogt-Koyanagi-Haradaf |
| Affections cardiaques | |
| Fréquent | tachycardie, fibrillation auriculaire |
| Peu fréquent | myocarditea, affections du péricardeh, arythmie (incluant arythmie ventriculaire) |
| Affections vasculaires | |
| Fréquent | hypertension |
| Rare | vascularite |
| Affections respiratoires, thoraciques et médiastinales | |
| Très fréquent | dyspnéea, toux |
| Fréquent | pneumopathie inflammatoirea, épanchement pleural |
| Peu fréquent | infiltration pulmonaire |
| Affections gastro-intestinales | |
| Très fréquent | diarrhée, vomissement, nausée, douleur abdominale, constipation |
| Fréquent | colitea, stomatite, sécheresse buccale |
| Peu fréquent | pancréatite, gastrite |
| Rare | ulcère duodénal |
| Affections hépatobiliaires | |
| Peu fréquent | hépatite, cholestase |
| Affections de la peau et du tissu sous-cutané | |
| Très fréquent | éruption cutanéec, prurit |
| Fréquent | vitiligo, peau sèche, érythème, alopécie |
| Peu fréquent | psoriasis, rosacée, érythème polymorphe, urticaire |
| Rare | nécrolyse épidermique toxiquea,d, syndrome de Stevens-Johnsona |
| Fréquence indéterminée | lichen scléro-atrophiqueg, autres formes de lichen |
| Affections musculo-squelettiques et systémiques | |
| Très fréquent | douleur musculo-squelettiquee, arthralgie |
| Fréquent | arthrite |
| Peu fréquent | pseudopolyarthrite rhizomélique |
| Rare |
syndrome
de Sjögren, myopathie, myosite (notamment polymyosite)a, rhabdomyolysea,d |
| Affections du rein et des voies urinaires | |
| Fréquent | insuffisance rénale (incluant insuffisance rénale aiguë)a |
| Peu fréquent | néphrite tubulo-interstitielle, cystite non infectieuse |
| Troubles généraux et anomalies au site d'administration | |
| Très fréquent | fatigue, fièvre |
| Fréquent | douleur, douleur thoracique, œdèmel |
| Investigationsb | |
| Très fréquent | augmentation du taux d'ASAT, hyponatrémie, hypoalbuminémie, augmentation du taux des phosphatases alcalines, augmentation du taux de créatinine, augmentation du taux d'ALAT, augmentation de la lipase, hyperkaliémie, augmentation de l'amylase, hypocalcémie, hypomagnésémie, hypokaliémie, hypercalcémie |
| Fréquent | augmentation du taux de bilirubine totale, hypernatrémie, hypermagnésémie |
Les
fréquences des effets indésirables présentées dans le Tableau 6 peuvent ne pas
être attribuables en totalité à nivolumab seul mais peuvent être en partie dues
à la maladie sous-jacente.
a Des cas d'issue fatale ont été rapportés dans les études cliniques terminées ou en cours.
b Les fréquences représentent la proportion de patients ayant présenté une aggravation des valeurs biologiques par rapport aux valeurs à l'inclusion. Voir ci-dessous : « Description des effets indésirables sélectionnés ; anomalies des valeurs biologiques ».
c Eruption cutanée est un terme composite incluant éruption cutanée maculopapuleuse, éruption cutanée érythémateuse, éruption cutanée prurigineuse, éruption cutanée folliculaire, éruption cutanée maculaire, éruption cutanée morbiliforme, éruption cutanée papuleuse, éruption cutanée pustuleuse, éruption cutanée vésiculaire, éruption cutanée exfoliative, dermatite, dermatite acnéiforme, dermatite allergique, dermatite atopique, dermatite bulleuse, dermatite exfoliative, dermatite psoriasiforme, toxidermie et pemphigoïde.
d Rapporté également dans des études en dehors des données poolées. La fréquence est basée sur l'exposition dans l'ensemble du programme.
e Douleur musculo-squelettique est un terme composite qui inclut douleur dorsale, douleur osseuse, douleur de type musculo-squelettique dans la poitrine, inconfort musculo-squelettique, myalgie, myalgie intercostale, douleur du cou, douleur des extrémités et douleur spinale.
f Evènement rapporté post-commercialisation (voir également rubrique Mises en garde spéciales et précautions d'emploi).
g Rapporté dans les études cliniques et dans le cadre de la post-commercialisation.
h Affections du péricarde est un terme composite incluant péricardite, épanchement péricardique, tamponnade cardiaque, et syndrome de Dressler.
i Anémie est un terme composite incluant, parmi d'autres causes, l'anémie hémolytique et l'anémie autoimmune, la diminution du taux d'hémoglobine, l'anémie ferriprive et la diminution du nombre de globules rouges.
j Inclut insuffisance surrénalienne, insuffisance corticosurrénalienne aiguë et insuffisance corticosurrénalienne secondaire.
k Inclut encéphalite et encéphalite limbique.
l Œdème est un terme composite incluant œdème généralisé, œdème périphérique, gonflement périphérique et gonflement.
a Des cas d'issue fatale ont été rapportés dans les études cliniques terminées ou en cours.
b Les fréquences représentent la proportion de patients ayant présenté une aggravation des valeurs biologiques par rapport aux valeurs à l'inclusion. Voir ci-dessous : « Description des effets indésirables sélectionnés ; anomalies des valeurs biologiques ».
c Eruption cutanée est un terme composite incluant éruption cutanée maculopapuleuse, éruption cutanée érythémateuse, éruption cutanée prurigineuse, éruption cutanée folliculaire, éruption cutanée maculaire, éruption cutanée morbiliforme, éruption cutanée papuleuse, éruption cutanée pustuleuse, éruption cutanée vésiculaire, éruption cutanée exfoliative, dermatite, dermatite acnéiforme, dermatite allergique, dermatite atopique, dermatite bulleuse, dermatite exfoliative, dermatite psoriasiforme, toxidermie et pemphigoïde.
d Rapporté également dans des études en dehors des données poolées. La fréquence est basée sur l'exposition dans l'ensemble du programme.
e Douleur musculo-squelettique est un terme composite qui inclut douleur dorsale, douleur osseuse, douleur de type musculo-squelettique dans la poitrine, inconfort musculo-squelettique, myalgie, myalgie intercostale, douleur du cou, douleur des extrémités et douleur spinale.
f Evènement rapporté post-commercialisation (voir également rubrique Mises en garde spéciales et précautions d'emploi).
g Rapporté dans les études cliniques et dans le cadre de la post-commercialisation.
h Affections du péricarde est un terme composite incluant péricardite, épanchement péricardique, tamponnade cardiaque, et syndrome de Dressler.
i Anémie est un terme composite incluant, parmi d'autres causes, l'anémie hémolytique et l'anémie autoimmune, la diminution du taux d'hémoglobine, l'anémie ferriprive et la diminution du nombre de globules rouges.
j Inclut insuffisance surrénalienne, insuffisance corticosurrénalienne aiguë et insuffisance corticosurrénalienne secondaire.
k Inclut encéphalite et encéphalite limbique.
l Œdème est un terme composite incluant œdème généralisé, œdème périphérique, gonflement périphérique et gonflement.
Nivolumab en association à d'autres agents thérapeutiques (voir rubrique Posologie et mode d'administration)
Résumé du profil de sécurité
Lorsque nivolumab est administré en association, consulter le RCP des autres
agents thérapeutiques pour plus d'informations sur leur profil de sécurité
avant d'initier le traitement.
Nivolumab
en association à l'ipilimumab (avec ou sans chimiothérapie)
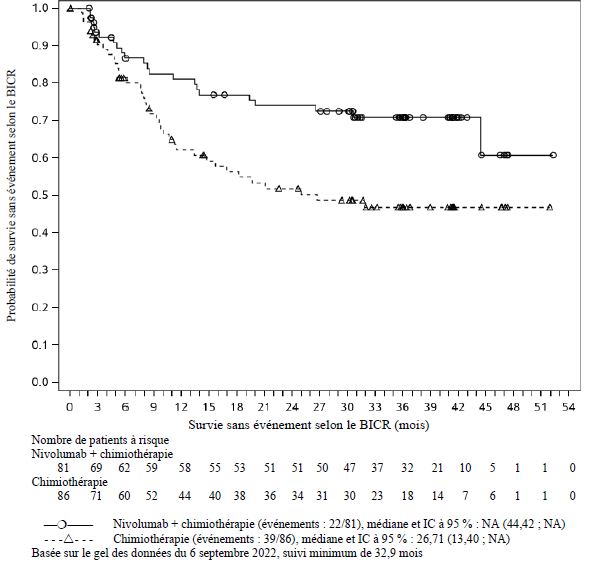
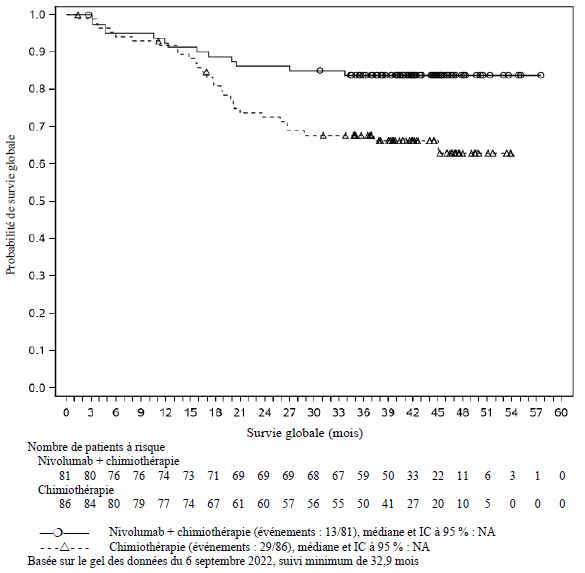
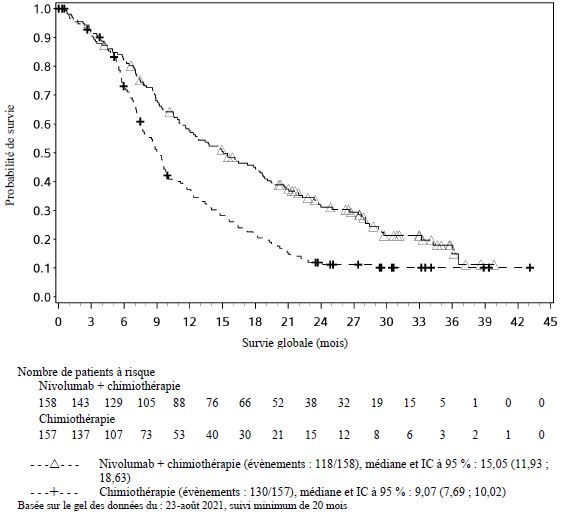
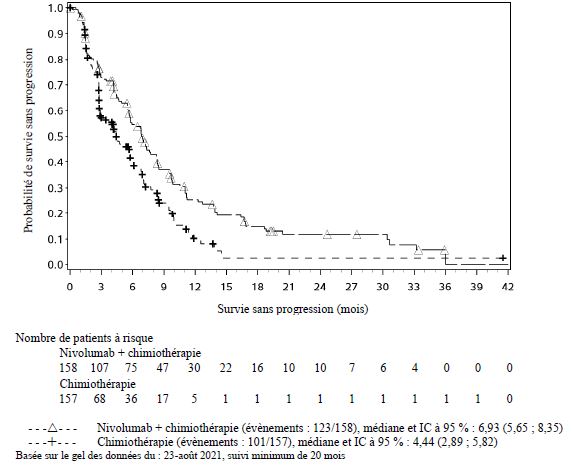
Dans l'ensemble des données poolées de nivolumab administré en association à l'ipilimumab (avec ou sans chimiothérapie) dans différents types de tumeurs (n = 2 094), avec un suivi minimum allant de 6 à 47 mois, les effets indésirables les plus fréquents (≥ 10 %) ont été : fatigue (50 %), éruption cutanée (38 %), diarrhée (37 %), nausée (31 %), prurit (29 %), douleur musculo-squelettique (28 %), fièvre (25 %), toux (24 %), diminution de l'appétit (23 %), vomissements (20 %), dyspnée (19 %), constipation (19 %), arthralgie (19 %), douleurs abdominales (18 %), hypothyroïdie (16 %), céphalée (16 %), infection des voies aériennes supérieures (15 %), œdème (13 %) et sensation vertigineuse (11 %). L'incidence des effets indésirables de Grades 3 à 5 était de 67 % pour le nivolumab en association à l'ipilimumab (avec ou sans chimiothérapie), dont 0,7 % de cas d'effets indésirables d'issue fatale attribués au traitement à l'étude. Chez les patients traités par nivolumab 1 mg/kg en association à l'ipilimumab 3 mg/kg, les effets indésirables signalés avec un taux d'incidence supérieur de ≥ 10 % par rapport aux taux signalés dans l'ensemble des données poolées de nivolumab en association à l'ipilimumab (avec ou sans chimiothérapie) ont été fatigue (62 %), éruption cutanée (57 %), diarrhée (52 %), nausée (42 %), prurit (40 %), fièvre (36 %) et céphalée (26 %). Chez les patients traités par nivolumab 360 mg en association à l'ipilimumab 1 mg/kg et à une chimiothérapie, les effets indésirables signalés avec un taux d'incidence supérieur de ≥ 10 % par rapport aux taux signalés dans l'ensemble des données poolées de nivolumab en association à l'ipilimumab (avec ou sans chimiothérapie) ont été anémie (32 %) et neutropénie (15 %).
Nivolumab
en association à une chimiothérapie
Dans l'ensemble des données poolées concernant nivolumab 240 mg toutes les 2
semaines ou 360 mg toutes les 3 semaines en association à une chimiothérapie
dans différents types de tumeurs (n = 1 268), avec un suivi minimum allant de
12,1 à 20 mois pour un adénocarcinome gastrique, de la JOG ou de l'œsophage, ou
un CEO, ou après 3 cycles de traitement pour un CBNPC résécable, les effets
indésirables les plus fréquents (≥ 10 %) ont été : nausée (51 %),
neuropathie périphérique (39 %), fatigue (39 %), diarrhée (33 %), diminution de
l'appétit (33 %), constipation (31 %), vomissements (27 %) stomatite (22 %),
douleurs abdominales (21 %), éruption cutanée (18 %), fièvre (17 %), douleurs
musculosquelettiques (16 %), toux (13 %), œdème (incluant œdème périphérique)
(12 %) et hypoalbuminémie (11 %). L'incidence des effets indésirables de Grades
3 à 5 était de 71 % pour nivolumab en association à une chimiothérapie, dont
1,2 % de cas d'effets indésirables d'issue fatale attribués au nivolumab en
association à une chimiothérapie. La durée médiane de traitement était de 6,44
mois (IC à 95 % : 5,95 ; 6,80) pour nivolumab en association à une
chimiothérapie et de 4,34 mois (IC à 95 % : 4,04 ; 4,70) pour la chimiothérapie
pour un adénocarcinome gastrique, de la JOG ou de l'œsophage, ou un CEO. Pour
le CBNPC résécable, quatre-vingt-treize pourcent (93 %) des patients ont reçu 3
cycles de nivolumab en association avec une chimiothérapie.
Nivolumab en association au cabozantinib
Dans l'ensemble des données concernant nivolumab 240 mg toutes les 2 semaines en association au cabozantinib 40 mg une fois par jour dans le CCR (n = 320), avec un suivi minimum de 16,0 mois les effets indésirables les plus fréquents (≥ 10 %) ont été : diarrhée (64,7 %), fatigue (51,3 %), syndrome d'érythrodysesthésie palmo-plantaire (40,0 %), stomatite (38,8 %), douleurs musculo-squelettiques (37,5 %), hypertension (37,2 %), éruption cutanée (36,3 %), hypothyroïdie (35,6 %), diminution de l'appétit (30,3 %), nausée (28,8 %), douleurs abdominales (25,0 %), dysgueusie (23,8 %), infection des voies respiratoires supérieures (20,6 %), toux (20,6 %), prurit (20,6 %), arthralgie (19,4 %), vomissements (18,4 %), dysphonie (17,8 %), céphalées (16,3 %), dyspepsie (15,9 %), vertiges (14,1 %), constipation (14,1 %), fièvre (14,1 %), œdème (13,4 %), spasmes musculaires (12,2 %), dyspnée (11,6 %), protéinurie (10,9 %) et hyperthyroïdie (10,0 %). L'incidence des effets indésirables de Grades 3 à 5 était de 78 %, dont 0,3 % de cas d'effets indésirables d'issue fatale attribués au traitement à l'étude.
Liste
tabulée des effets indésirables
Les effets indésirables rapportés dans l'ensemble des données poolées chez les
patients traités par nivolumab en association à l'ipilimumab (avec ou sans
chimiothérapie) (n = 2 094), par nivolumab en association à une chimiothérapie
(n = 1 268) et par nivolumab en association au cabozantinib (n = 320) sont
présentés dans le Tableau 7. Ces effets indésirables sont présentés par classe
de systèmes d'organes et par ordre de fréquence. Les fréquences sont définies
comme suit : très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10)
; peu fréquent (≥ 1/1 000, < 1/100) ; rare (≥ 1/10 000, < 1/1
000) ; fréquence indéterminée (ne peut être estimée sur la base des données
post-commercialisation disponibles). Au sein de chaque groupe de fréquence, les
effets indésirables sont présentés suivant un ordre de gravité décroissant.
Tableau 7 : Effets indésirables du nivolumab en association à l'ipilimumab
| En association à l'ipilimumab (avec ou sans chimiothérapie) | En association à une chimiothérapie | En association au cabozantinib | |
| Infections et infestations | |||
| Très fréquent | infection des voies aériennes supérieures | infection des voies aériennes supérieures | |
| Fréquent | pneumonie, bronchite, conjonctivite | infection des voies aériennes supérieures, pneumoniea | pneumonie |
| Rare | méningite aseptique | ||
| Affections hématologiques et du système lymphatique | |||
| Très fréquent | anémieb,i, thrombopénieb, leucopénieb, lymphopénieb, neutropénieb | neutropénieb, anémieb,i, leucopénieb, lymphopénieb, thrombopénieb | anémieb, thrombopénieb, leucopénieb, lymphopénieb, neutropénieb |
| Fréquent | éosinophilie | neutropénie fébrilea | éosinophilie |
| Peu fréquent | neutropénie fébrile | éosinophilie | |
| Fréquence indéterminée | lymphohistiocytose hémophagocytaire | ||
| Affections du système immunitaire | |||
| Fréquent | rréaction liée à la perfusion (incluant syndrome de libération de cytokine), hypersensibilité | hypersensibilité, réaction liée à la perfusion (incluant syndrome de libération de cytokine) | hypersensibilité (incluant réaction anaphylactique) |
| Peu fréquent | réaction d'hypersensibilité liée à la perfusion | ||
| Rare | sarcoïdose | ||
| Fréquence indéterminée | rejet de greffe d'organe solidef | ||
| Affections endocriniennes | |||
| Très fréquent | hypothyroïdie | hypothyroïdie, hyperthyroïdie | |
| Fréquent | hyperthyroïdie, thyroïdite, insuffisance surrénalienne, hypophysite, hypopituitarisme, diabète sucré | hypothyroïdie, hyperthyroïdie | insuffisance surrénalienne |
| Peu fréquent | acidocétose diabétique | insuffisance surrénalienne, thyroïdite, hypopituitarisme, diabète sucré | hypophysite, thyroïdite |
| Rare | hypoparathyroïdie | hypophysite | |
| Troubles du métabolisme et de la nutrition | |||
| Très fréquent | diminution de l'appétit, hyperglycémieb, hypoglycémieb | diminution de l'appétit, hypoalbuminémie, hyperglycémieb, hypoglycémieb | diminution de l'appétit, hypoglycémieb, hyperglycémieb, perte de poids |
| Fréquent | déshydratation, hypoalbuminémie, hypophosphatémie, perte de poids | hypophosphatémie | déshydratation |
| Peu fréquent | acidose métabolique | ||
| Rare | syndrome de lyse tumorale | ||
| Fréquence indéterminée | syndrome de lyse tumoraleg | ||
| Affections du système nerveux | |||
| Très fréquent | céphalée, sensation vertigineuse | neuropathie périphérique | dysgueusie, sensation vertigineuse, céphalées |
| Fréquent | neuropathie périphérique | paresthésie, sensation vertigineuse, céphalées | neuropathie périphérique |
| Peu fréquent | polyneuropathie, paralysie du nerf péronier, neuropathie auto-immune (incluant parésie des nerfs facial et abducens), encéphalite, myasthénie grave | encéphalite auto-immune, syndrome de Guillain-Barré, syndrome myasthénique | |
| Rare | syndrome de Guillain-Barré, névrite | syndrome de Guillain-Barré, encéphalite | |
| Affections de l'oreille et du labyrinthe | |||
| Fréquent | acouphènes | ||
| Affections oculaires | |||
| Fréquent | vision trouble, sécheresse oculaire | sécheresse oculaire, vision trouble | sécheresse oculaire, vision trouble |
| Peu fréquent | uvéite, épisclérite | uvéite | uvéite |
| Rare | syndrome de Vogt-Koyanagi-Haradag | ||
| Affections cardiaques | |||
| Fréquent | tachycardie, fibrillation auriculaire | tachycardie, fibrillation auriculaire | fibrillation auriculaire, tachycardie |
| Peu fréquent | myocarditea, arythmie (incluant arythmie ventriculaire)a, bradycardie | myocardite | myocardite |
| Fréquence indéterminée | affections du péricardeh | ||
| Affections vasculaires | |||
| Très fréquent | hypertension | ||
| Fréquent | hypertension | thrombosea,j, hypertension, vascularite | thrombosej |
| Affections respiratoires, thoraciques et médiastinales | |||
| Très fréquent | toux, dyspnée | toux | dysphonie, dyspnée, toux |
| Fréquent | pneumopathie inflammatoirea, embolie pulmonairea, épanchement pleural | pneumopathie inflammatoirea, dyspnée | pneumopathie inflammatoire, embolie pulmonaire, épanchement pleural, épistaxis |
| Affections gastro-intestinales | |||
| Très fréquent | diarrhée, vomissements, nausée, douleurs abdominales, constipation | diarrhéea, stomatite, vomissements, nausée, douleurs abdominales, constipation | diarrhée, vomissements, nausée, constipation, stomatite, douleurs abdominales, dyspepsie |
| Fréquent | colitea, pancréatite, stomatite, gastrite, sécheresse buccale | colite, sécheresse buccale | colite, gastrite, douleur buccale, sécheresse buccale, hémorroïdes |
| Peu fréquent | duodénite | pancréatite | pancréatite, perforation de l'intestin grêlea, glossodynie |
| Rare | perforation intestinalea | ||
| Affections hépatobiliaires | |||
| Fréquent | hépatite | hépatite | |
| Peu fréquent | hépatite | ||
| Affections de la peau et du tissu sous-cutané | |||
| Très fréquent | éruption cutanéec, prurit | éruption cutanéec | syndrome d'érythrodysesthésie palmo-plantaire, éruption cutanéec, prurit |
| Fréquent | alopécie, vitiligo, urticaire, peau sèche, érythème | syndrome d'érythrodysesthésie palmo-plantaire, prurit, hyperpigmentation de la peau, alopécie, peau sèche, érythème | alopécie, sécheresse cutanée, érythème, changement de la couleur des cheveux |
| Peu fréquent | syndrome de Stevens-Johnson, érythème polymorphe, psoriasis | psoriasis, urticaire | |
| Rare | nécrolyse épidermique toxiquea,d, lichen scléro-atrophique, autres formes de lichen | ||
| Fréquence indéterminée | lichen scléro-atrophique, autres formes de lichen | ||
| Affections musculo-squelettiques et du tissu conjonctif | |||
| Très fréquent | douleur musculo-squelettiquee, arthralgie | douleur musculo-squelettiquee | douleur musculo-squelettiquee, arthralgie, spasmes musculaires |
| Fréquent | spasmes musculaires, faiblesse musculaire, arthrite | arthralgie, faiblesse musculaire | arthrite |
| Peu fréquent | pseudopolyarthrite rhizomélique, myopathie, myosite (notamment polymyosite)a | myopathie, ostéonécrose de la mâchoire, fistule | |
| Rare | spondyloarthropathie, syndrome de Sjögren, rhabdomyolysea | ||
| Affections du rein et des voies urinaires | |||
| Très fréquent | protéinurie | ||
| Fréquent | insuffisance rénale (incluant insuffisance rénale aiguë)a | insuffisance rénalea | insuffisance rénale, insuffisance rénale aiguë |
| Peu fréquent | néphrite tubulo-interstitielle, néphrite | cystite non infectieuse | néphrite |
| Rare | cystite non infectieuse | néphrite | cystite non infectieuseg |
| Troubles généraux et anomalies au site d'administration | |||
| Très fréquent | fatigue, fièvre, œdème (incluant œdème périphérique) | fatigue, fièvre, œdème (incluant œdème périphérique) | fatigue, fièvre, œdème |
| Fréquent | douleur thoracique, douleur, frissons | malaise | douleur, douleur thoracique |
| Investigationsb | |||
| Très fréquent | augmentation du taux de phosphatases alcalinesb, augmentation du taux d'ASATb, augmentation du taux d'ALATb, augmentation du taux de bilirubine totaleb, augmentation du taux de créatinineb, augmentation de l'amylaseb, augmentation de la lipaseb, hyponatrémieb, hyperkaliémieb, hypokaliémieb, hypercalcémieb, hypocalcémieb | hypocalcémieb , augmentation du taux des transaminasesb , hyponatrémieb , augmentation de l’amylaseb , hypomagnésémieb , augmentation du taux de phosphatases alcalinesb , hypokaliémieb , augmentation du taux de créatinineb, augmentation de la lipaseb , hyperkaliémieb , augmentation du taux de bilirubine totaleb | augmentation du taux de phosphatases alcalinesb, augmentation du taux d'ALATb, augmentation du taux d'ASATb, augmentation du taux de bilirubine totaleb, augmentation du taux de créatinineb, augmentation de l'amylaseb, augmentation de la lipaseb, hypokaliémieb, hypomagnésémieb, hyponatrémieb, hypocalcémieb, hypercalcémieb, hypophosphatémieb, hyperkaliémieb, hypermagnésémieb, hypernatrémieb |
| Fréquent | hypernatrémieb, hypermagnésémieb, augmentation du taux de la thyréostimuline, augmentation du taux de gamma-glutamyltransférase | hypernatrémieb, hypercalcémieb, hypermagnésémieb | augmentation de la cholestérolémie, hypertriglycéridémie |
Les
effets indésirables présentés dans le Tableau 7 peuvent ne pas être entièrement
attribuables au nivolumab seul ou en association à d'autres agents
thérapeutiques, mais peuvent être dus en partie à la maladie sous-jacente ou au
médicament utilisé en association.
a Des cas d'issue fatale ont été rapportés dans les études cliniques terminées ou en cours.
b Les fréquences représentent la proportion de patients ayant présenté une aggravation des valeurs biologiques par rapport aux valeurs à l'inclusion. Voir ci-dessous : « Description des effets indésirables sélectionnés ; anomalies des valeurs biologiques ».
c Éruption cutanée est un terme composite incluant éruption cutanée maculopapuleuse, éruption cutanée érythémateuse, éruption cutanée prurigineuse, éruption cutanée folliculaire, éruption cutanée maculaire, éruption cutanée morbiliforme, éruption cutanée papuleuse, éruption cutanée pustuleuse, éruption cutanée papulosquameuse, éruption cutanée vésiculaire, éruption cutanée généralisée, éruption cutanée exfoliative, dermatite, dermatite acnéiforme, dermatite allergique, dermatite atopique, dermatite bulleuse, dermatite exfoliative, dermatite psoriasiforme, toxidermie, éruption cutanée nodulaire et pemphigoïde.
d Rapporté également dans des études en dehors des données poolées. La fréquence est basée sur l'exposition dans l'ensemble du programme.
e Douleur musculo-squelettique est un terme composite qui inclut douleur dorsale, douleur osseuse, douleur de type musculo-squelettique dans la poitrine, inconfort musculo-squelettique, myalgie, myalgie intercostale, douleur du cou, douleur des extrémités et douleur spinale.
f Événement rapporté post-commercialisation (voir également rubrique Mises en garde spéciales et précautions d'emploi).
g Rapporté dans les études cliniques et dans le cadre de la post-commercialisation.
h Affections du péricarde est un terme composite incluant péricardite, épanchement péricardique, tamponnade cardiaque et syndrome de Dressler.
i Anémie est un terme composite incluant, parmi d'autres causes, l'anémie hémolytique et l'anémie auto-immune, la diminution du taux d'hémoglobine, l'anémie ferriprive et la diminution du nombre de globules rouges.
j Thrombose est un terme composite qui inclut thrombose de la veine porte, thrombose de la veine pulmonaire, thrombose pulmonaire, thrombose aortique, thrombose artérielle, thrombose des veines profondes, thrombose de la veine pelvienne, thrombose de la veine cave, thrombus veineux, thrombose veineuse des membres.
a Des cas d'issue fatale ont été rapportés dans les études cliniques terminées ou en cours.
b Les fréquences représentent la proportion de patients ayant présenté une aggravation des valeurs biologiques par rapport aux valeurs à l'inclusion. Voir ci-dessous : « Description des effets indésirables sélectionnés ; anomalies des valeurs biologiques ».
c Éruption cutanée est un terme composite incluant éruption cutanée maculopapuleuse, éruption cutanée érythémateuse, éruption cutanée prurigineuse, éruption cutanée folliculaire, éruption cutanée maculaire, éruption cutanée morbiliforme, éruption cutanée papuleuse, éruption cutanée pustuleuse, éruption cutanée papulosquameuse, éruption cutanée vésiculaire, éruption cutanée généralisée, éruption cutanée exfoliative, dermatite, dermatite acnéiforme, dermatite allergique, dermatite atopique, dermatite bulleuse, dermatite exfoliative, dermatite psoriasiforme, toxidermie, éruption cutanée nodulaire et pemphigoïde.
d Rapporté également dans des études en dehors des données poolées. La fréquence est basée sur l'exposition dans l'ensemble du programme.
e Douleur musculo-squelettique est un terme composite qui inclut douleur dorsale, douleur osseuse, douleur de type musculo-squelettique dans la poitrine, inconfort musculo-squelettique, myalgie, myalgie intercostale, douleur du cou, douleur des extrémités et douleur spinale.
f Événement rapporté post-commercialisation (voir également rubrique Mises en garde spéciales et précautions d'emploi).
g Rapporté dans les études cliniques et dans le cadre de la post-commercialisation.
h Affections du péricarde est un terme composite incluant péricardite, épanchement péricardique, tamponnade cardiaque et syndrome de Dressler.
i Anémie est un terme composite incluant, parmi d'autres causes, l'anémie hémolytique et l'anémie auto-immune, la diminution du taux d'hémoglobine, l'anémie ferriprive et la diminution du nombre de globules rouges.
j Thrombose est un terme composite qui inclut thrombose de la veine porte, thrombose de la veine pulmonaire, thrombose pulmonaire, thrombose aortique, thrombose artérielle, thrombose des veines profondes, thrombose de la veine pelvienne, thrombose de la veine cave, thrombus veineux, thrombose veineuse des membres.
Description
des effets indésirables sélectionnés
Nivolumab ou nivolumab en association à d'autres agents thérapeutiques est
associé à des effets indésirables d'origine immunologique. Avec un traitement
médical approprié, les effets indésirables d'origine immunologique ont été résolus
dans la plupart des cas. L'arrêt définitif du traitement a été nécessaire
généralement chez une plus grande proportion de patients recevant nivolumab en
association à d'autres agents que chez ceux recevant nivolumab en monothérapie.
Le Tableau 8 présente le pourcentage des patients ayant développé des effets
indésirables d'origine immunologiquequi ont définitivement arrêté le
traitement, en fonction du schéma posologique. En outre, chez les patients qui
ont présenté un événement, le Tableau 8 présente le pourcentage des patients
qui ont nécessité des doses élevées de corticoïdes (au moins 40 mg de
prednisone ou équivalent par jour), en fonction du schéma posologique. Les
recommandations de prise en charge de ces effets indésirables sont décrites en
rubrique Mises en garde spéciales et précautions d'emploi.
Tableau 8 : Effets indésirables d'origine immunologique entraînant l'arrêt définitif ou nécessitant des doses élevées de corticoïdes, en fonction du schéma posologique (nivolumab en monothérapie, nivolumab en association à l'ipilimumab (avec ou sans chimiothérapie), nivolumab en association à une chimiothérapie ou nivolumab en association au cabozantinib)
|
Nivolumab en monothérapie % |
Nivolumab en association à
l'ipilimumab (avec ou sans chimiothérapie) % |
Nivolumab en association à
une chimiothérapie % |
Nivolumab en association
au cabozantinib % |
|
| Effet indésirable d'origine immunologique entraînant l'arrêt définitif | ||||
| Pneumopathie inflammatoire | 1,4 | 2,5 | 2,1 | 2,5 |
| Colite | 1,2 | 6 | 2,1 | 2,5 |
| Hépatite | 1,1 | 5 | 1,0 | 4,1 |
| Néphrite et dysfonctionnement rénal | 0,3 | 1,2 | 3,0 | 0,6 |
| Endocrinopathies | 0,5 | 2,0 | 0,5 | 1,3 |
| Peau | 0,8 | 1,0 | 1,1 | 2,2 |
| Hypersensibilité/Réaction à la perfusion | 0,1 | 0,3 | 2,3 | 0 |
| Effet indésirable d'origine immunologique nécessitant des doses élevées de corticoïdesa,b | ||||
| Pneumopathie inflammatoire | 65 | 59 | 59 | 56 |
| Colite | 14 | 32 | 8 | 8 |
| Hépatite | 21 | 37 | 8 | 23 |
| Néphrite et dysfonctionnement rénal | 22 | 27 | 9 | 9 |
| Endocrinopathies |
5 |
20 | 5 | 4,2 |
| Peau |
3,3 |
8 | 6 | 8 |
| Hypersensibilité/Réaction à la perfusion | 18 | 16 | 23 | 0 |
a au moins 40 mg d'équivalent prednisone par jour
b la fréquence est basée sur le nombre de patients qui ont présenté l'effet indésirable d'origine immunologique
b la fréquence est basée sur le nombre de patients qui ont présenté l'effet indésirable d'origine immunologique
Pneumopathie inflammatoire d'origine immunologique
Chez les patients traités par nivolumab en monothérapie, l'incidence des pneumopathies
inflammatoires, incluant pneumopathie interstitielle diffuse et infiltration pulmonaire, était
de 3,3 % (155/4 646). La majorité des cas étaient de Grade 1 ou 2 en sévérité et ont été rapportés
chez 0,9 % (42/4 646) et 1,7 % (77/4 646) des patients, respectivement. Des cas de Grade 3 et 4 ont
été rapportés chez 0,7 % (33/4 646) et < 0,1 % (1/4 646) des patients, respectivement. Six patients
(0,1 %) sont décédés. Le délai médian de survenue était de 15,1 semaines (de 0,7 à 85,1 semaines). La
résolution est survenue chez 107 patients (69,0 %) avec un délai médian de résolution de 6,7 semaines
(de 0,1+ à 109,1+ semaines) ; + indique une donnée censurée.
Chez les patients traités par nivolumab en association à l'ipilimumab (avec ou sans chimiothérapie), l'incidence des pneumopathies inflammatoires, incluant pneumopathie interstitielle diffuse, était de 6,9 % (145/2 094). Des cas de Grade 2, Grade 3 et Grade 4 ont été rapportés chez respectivement 3,5 % (73/2 094), 1,1 % (24/2 094) et 0,4 % (8/2 094) des patients. Quatre patients (0,2 %) sont décédés. Le délai médian de survenue était de 2,7 mois (de 0,1 à 56,8 mois). Une résolution est survenue chez 119 patients (82,1 %) avec un délai médian de résolution de 6,1 semaines (de 0,3 à 149,3+ semaines).
Chez les patients traités par nivolumab en association à une chimiothérapie, l'incidence des pneumopathies inflammatoires, incluant pneumopathie interstitielle diffuse, était de 4,8 % (61/1 268). Des cas de Grade 2, Grade 3, et Grade 4 ont été rapportés chez respectivement 2,4 % (31/1 268), 1,0 % (13/1 268), et 0,2 % (3/1 268) des patients. Deux patients (0,2 %) sont décédés. Le délai médian de survenue était de 24,1 semaines (de 1,6 à 96,9 semaines). Une résolution est survenue chez 42 patients (68,9 %) avec un délai médian de résolution de 10,4 semaines (de 0,3+ à 121,3+ semaines).
Chez les patients traités par nivolumab en association au cabozantinib, l'incidence des pneumopathies inflammatoires, incluant pneumopathie interstitielle diffuse, était de 5,6 % (18/320). Des cas de Grade 2 et Grade 3 ont été rapportés chez respectivement 1,9 % (6/320) et 1,6 % (5/320) des patients. Le délai médian de survenue était de 26,9 semaines (de 12,3 à 74,3 semaines). Une résolution est survenue chez 14 patients (77,8 %) avec un délai médian de résolution de 7,5 semaines (de 2,1 à 60,7+ semaines).
Colite d'origine immunologique
Chez les patients traités par nivolumab en monothérapie, l'incidence des diarrhées, colites ou selles
fréquentes était de 15,4 % (716/4 646). La majorité des cas étaient de Grade 1 ou 2 en sévérité et ont
été rapportés chez 9,9 % (462/4 646) et 4,0 % (186/4 646) des patients, respectivement. Des cas de
Grade 3 et 4 ont été rapportés chez 1,4 % (67/4 646) et < 0,1 % (1/4 646) des patients respectivement.
Le délai médian de survenue était de 8,3 semaines (de 0,1 à 115,6 semaines). Une résolution est
survenue chez 639 patients (90,3 %) avec un délai médian de résolution de 2,9 semaines (de 0,1
à 124,4+ semaines).
Chez les patients traités par nivolumab en association à l'ipilimumab (avec ou sans chimiothérapie), l'incidence des diarrhées ou des colites était de 27,7 % (580/2 094). Des cas de Grade 2, Grade 3 et Grade 4 ont été rapportés chez respectivement 8,8 % (184/2 094), 6,8 % (142/2 094) et 0,1 % (3/2 094) des patients. Un patient (< 0,1 %) est décédé. Le délai médian de survenue était de 1,4 mois (de 0,0 à 48,9 mois). Une résolution est survenue chez 577 patients (90,8 %) avec un délai médian de résolution de 2,7 semaines (de 0,1 à 159,4+ semaines). Chez les patients traités par nivolumab 1 mg/kg en association à l'ipilimumab 3 mg/kg, l'incidence des diarrhées ou colites était de 46,7 %, avec des cas de Grade 2 (13,6 %), de Grade 3 (15,8 %) et de Grade 4 (0,4 %).
Chez les patients traités par nivolumab en association à une chimiothérapie, l'incidence des diarrhées ou des colites était de 26,4 % (335/11 268). Des cas de Grade 2, Grade 3, et Grade 4 ont été rapportés chez respectivement 8,2 % (104/1 268), 3,5 % (45/1 268), et 0,5 % (6/1 268) des patients. Un patient (< 0,1 %) est décédé. Le délai médian de survenue était de 4,3 semaines (de 0,1 à 93,6 semaines). Une résolution est survenue chez 293 patients (88,0 %) avec un délai médian de résolution de 1,4 semaine (de 0,1 à 117,6+ semaines).
Chez les patients traités par nivolumab en association au cabozantinib, l'incidence des diarrhées, colites, selles fréquentes ou entérites était de 59,1 % (189/320). Des cas de Grade 2 et Grade 3 ont été rapportés respectivement chez 25,6 % (82/320) et 6,3 % (20/320) des patients. Des cas de Grade 4 ont été rapportés chez 0,6 % (2/320) des patients. Le délai médian de survenue était de 12,9 semaines (de 0,3 à 110,9 semaines). Une résolution est survenue chez 143 patients (76,1 %) avec un délai médian de survenue de 12,9 semaines (de 0,1 à 139,7+ semaines).
Hépatite
d'origine immunologique
Chez les patients traités par nivolumab en monothérapie, l'incidence des anomalies de la fonction
hépatique était de 8,0 % (371/4 646). La majorité des cas étaient de Grade 1 ou 2 en sévérité et ont été
rapportés chez 4,3 % (200/4 646) et 1,8 % (82/4 646) des patients respectivement. Des cas de
Grade 3 et 4 ont été rapportés chez 1,6 % (74/4 646) et 0,3 % (15/4 646) des patients, respectivement.
Le délai médian de survenue était de 10,6 semaines (de 0,1 à 132,0 semaines). Une résolution est
survenue chez 298 patients (81,4 %) avec un délai médian de résolution de 6,1 semaines
(de 0,1 à 126,4+ semaines).
Chez les patients traités par nivolumab en association à l'ipilimumab (avec ou
sans chimiothérapie), l'incidence des anomalies de la fonction hépatique était
de 19,2 % (402/2 094). Des cas de Grade 2, Grade 3 et Grade 4 ont été rapportés
chez respectivement 4,2 % (88/2 094), 7,8 % (163/2 094) et 1,2 % (25/2 094) des
patients. Le délai médian de survenue était de 1,9 mois (de 0,0 à 36,6 mois).
Une résolution est survenue chez 351 patients (87,8 %) avec un délai médian de
résolution de 5,3 semaines (de 0,1 à 175,9+ semaines). Chez les
patients traités par nivolumab 1 mg/kg en association à l'ipilimumab 3 mg/kg,
l'incidence des anomalies de la fonction hépatique était de 30,1 % avec des cas
de Grade 2 (6,9 %), de Grade 3 (15,8 %) et de Grade 4 (1,8 %).
Chez les patients traités par nivolumab en association à une chimiothérapie,
l'incidence des anomalies de la fonction hépatique était de 20 % (253/1 268).
Des cas de Grade 2, Grade 3 et Grade 4 ont été rapportés chez 6,2 % (78/1 268),
2,9 % (37/1 268) et < 0,1 % (1/1 268) des patients, respectivement. Le délai
médian de survenue était de 7,0 semaines (de 0,1 à 84,1 semaines). Une
résolution est survenue chez 202 patients (81,1 %) avec un délai médian de
résolution de 7,4 semaines (de 0,4 à 150,6+ semaines).
Chez les patients traités par nivolumab en association au cabozantinib,
l'incidence des anomalies de la fonction hépatique était de 41,6 % (133/320).
Des cas de Grade 2, Grade 3 et Grade 4 ont été rapportés chez respectivement
14,7 % (47/320), 10,3 % (33/320), et 0,6 % (2/320) des patients. Le délai
médian de survenue était de 8,3 semaines (de 0,1 à 107,9 semaines). Une
résolution est survenue chez 101 patients (75,9 %) avec un délai médian de
résolution de 9,6 semaines (de 0,1 à 89,3+ semaines).
Néphrite et dysfonction rénale d'origine immunologique
Chez les patients traités par nivolumab en monothérapie, l'incidence des néphrites ou des dysfonctions
rénales était de 2,6 % (121/4 646). La majorité des cas étaient de Grade 1 ou 2 en sévérité et a été
rapportée chez 1,5 % (69/4 646) et 0,7 % (32/4 646) des patients, respectivement. Des cas de Grade 3
et 4 ont été rapportés chez 0,4 % (18/4 646) et < 0,1 % (2/4 646) des patients, respectivement. Le délai
médian de survenue était de 12,1 semaines (de 0,1 à 79,1 semaines). Une résolution est survenue chez
80 patients (69,0 %) avec un délai médian de résolution de 8,0 semaines (de 0,3 à 79,1+ semaines).
Chez les patients traités par nivolumab en association à l'ipilimumab (avec ou
sans chimiothérapie), l'incidence des néphrites ou des dysfonctions rénales était
de 6,1 % (128/2 094). Des cas de Grade 2, Grade 3 et Grade 4 ont été rapportés
chez respectivement 2,3 % (49/2 094), 1,0 % (20/2 094) et 0,5 % (10/20 94) des
patients. Deux patients (< 0,1 %) sont décédés. Le délai médian de survenue
était de 2,5 mois (de 0,0 à 34,8 mois). Une résolution est survenue chez 97
patients (75,8 %) avec un délai médian de résolution de 6,3 semaines (de 0,1 à
172,1+ semaines).
Chez les patients traités par nivolumab en association à une chimiothérapie,
l'incidence des néphrites ou des dysfonctions rénales était de 8,8 % (112/1
268). Des cas de Grade 2, Grade 3 et Grade 4 ont été rapportés chez 3,3 % (42/1
268), 1,0 % (13/1 268) et 0,2 % (2/1 268) des patients respectivement. Un
patient (< 0,1 %) est décédé. Le délai médian de survenue était de 9,6
semaines (de 0,7 à 60,7 semaines). Une résolution est survenue chez 72 patients
(64,3 %) avec un délai médian de résolution de 11,1 semaines (de 0,1 à 191,1+
semaines).
Chez les patients traités par nivolumab en association au cabozantinib,
l'incidence des néphrites, des néphrites immuno-médiées, d'insuffisance rénale,
d'insuffisance rénale aiguë, de l'augmentation du taux de créatinine ou d'urée
dans le sang était de 10,0 % (32/320). Des cas de Grade 2 et Grade 3 ont été
rapportés chez respectivement 3,4 % (11/320), et 1,3 % (4/320) des patients. Le
délai médian de survenue était de 14,2 semaines (de 2,1 à 87,1 semaines). Une
résolution est survenue chez 18 patients (58,1 %) avec un délai médian de
résolution de 10,1 semaines (de 0,6 à 90,9+ semaines).
Endocrinopathies d'origine immunologique
Chez
les patients traités par nivolumab en monothérapie, l'incidence des
troubles thyroïdiens, incluant
hypothyroïdie et hyperthyroïdie, était de 13,0 % (603/4 646). La
majorité des cas était de Grade 1 ou 2
en sévérité et a été rapportée chez 6,6 % (305/4 646) et 6,2 % (290/4
646) des patients,
respectivement. Des troubles thyroïdiens de Grade 3 ont été rapportés
chez 0,2 % (8/4 646) des patients. Des hypophysites (3 de Grade 1, 7 de
Grade 2, 9 de Grade 3 et 1 de Grade 4), des
hypopituitarismes (6 de Grade 2 et 1 de Grade 3), des insuffisances
surrénaliennes (incluant une
insuffisance corticosurrénalienne secondaire, une insuffisance
corticosurrénalienne aiguë et une
diminution de la corticotropine sanguine) (2 de Grade 1, 23 de Grade 2,
et 11 de Grade 3), des cas de
diabète sucré (incluant diabète sucré de type 1 et acidocétose
diabétique) (1 de Grade 1, 3 de Grade 2,
8 de Grade 3 et 2 de Grade 4) ont été rapportés. Le délai médian de
survenue de ces endocrinopathies
était de 11,1 semaines (de 0,1 à 126,7 semaines). Une résolution est
survenue chez 323 patients
(48,7 %). Le délai médian de résolution était de 48,6 semaines (de 0,4
à 204,4+ semaines).
Chez les patients traités par nivolumab en association à l'ipilimumab (avec ou
sans chimiothérapie), l'incidence des troubles thyroïdiens était de 22,9 %
(479/2 094). Des troubles thyroïdiens de Grade 2 et de Grade 3 ont été
rapportés chez respectivement 12,5 % (261/2 094) et 1,0 % (21/2 094) des
patients. Des hypophysites de Grade 2 et de Grade 3 (incluant une hypophysite
lymphocytaire) sont survenues chez respectivement 2,0 % (42/2 094) et 1,6 %
(33/2 094) des patients. Des hypopituitarismes de Grade 2 et de Grade 3 sont
survenus chez respectivement 0,8 % (16/2 094) et 0,5 % (11/2 094) des patients.
Des insuffisances surrénaliennes de Grade 2, de Grade 3 et de Grade 4 (incluant
une insuffisance corticosurrénalienne secondaire) sont survenues chez
respectivement 2,3 % (49/2 094), 1,5 % (32/2094) et 0,2 % (4/2 094) des
patients. Des cas de diabète sucré de Grade 1, de Grade 2, de Grade 3 et de
Grade 4 ont été rapportés chez respectivement 0,1 % (1/2 094), 0,2 % (4/2 094),
< 0,1 % (1/2 094) et 0,1 % (3/2 094) des patients et une acidocétose
diabétique de Grade 4 a été rapportée chez < 0,1 % (2/2 094) des patients.
Le délai médian de survenue de ces endocrinopathies était de 2,1 mois (de 0,0 à
28,1 mois). Une résolution est survenue chez 201 patients (40,7 %). Le délai de
résolution allait de 0,3 à 257,1+ semaines.
Chez les patients traités par nivolumab en association à une chimiothérapie,
l'incidence des troubles thyroïdiens était de 10,8 % (137/1 268). Des cas de
troubles thyroïdiens de Grade 2 ont été rapportés chez 4,8 % (61/1 268) des
patients. Des cas d'hypophysite de Grade 3 ont été rapportés chez < 0,1 %
(1/1 268) des patients. Des cas d'hypopituitarisme de Grade 2 et Grade 3 ont
été rapportés chez respectivement 0,2 % (3/1 268) et 0,2 % (3/1 268) des
patients. Des cas d'insuffisance surrénalienne de Grade 2, Grade 3 et Grade 4
ont été rapportés chez respectivement 0,6 % (8/1 268), 0,2 % (2/1 268) et <
0,1 % (1/1 268) des patients. Des cas de diabète sucré, notamment de diabète
sucré de type 1 et de diabète sucré fulminant de type 1 (2 de Grade 2, 2 de
Grade 3 et 1 de Grade 4), et d'acidocétose diabétique (1 de Grade 4) ont été
rapportés. Le délai médian de survenue de ces endocrinopathies était de 13,0
semaines (de 2,0 à 124,3 semaines). Une résolution est survenue chez 63
patients (40,9 %). Le délai médian de résolution était de 0,4 à 221,6+
semaines.
Chez les patients traités par nivolumab en association au cabozantinib,
l'incidence des troubles thyroïdiens était de 43,1 % (138/320). Des troubles
thyroïdiens de Grade 2 et de Grade 3 ont été rapportés chez respectivement 23,1
% (74/320) et 0,9 % (3/320) des patients. Des hypophysites, toutes de Grade 2,
sont survenues chez 0,6 % (2/320) des patients. Des insuffisances
surrénaliennes (incluant des insuffisances cortico-surrénaliennes secondaires)
sont survenues chez 4,7 % (15/320) des patients. Des insuffisances
surrénaliennes de Grade 2 et de Grade 3 ont été rapportées chez respectivement
2,2 % (7/320) et 1,9 % (6/320) des patients. Le délai médian de survenue des
endocrinopathies était de 12,3 semaines (de 2,0 à 89,7 semaines). Une
résolution est survenue chez 50 patients (35,2 %). Le délai de résolution
allait de 0,9 à 132,0+ semaines.
Effets indésirables cutanés d'origine immunologique
Chez les patients traités par nivolumab en monothérapie, l'incidence des éruptions cutanées était
de 30,0 % (1 396/4 646). La majorité des cas étaient de Grade 1 en sévérité et ont été rapportés chez
22,8 % (1 060/4 646) des patients. Des cas de Grade 2 et de Grade 3 ont été rapportés
chez 5,9 % (274/4 646) et 1,3 (62/4 646) des patients, respectivement. Le délai médian de survenue
était de 6,7 semaines (de 0,1 à 121,1 semaines). Une résolution est survenue chez 896 patients
(64,6 %), avec un délai médian de résolution de 20,1 semaines (de 0,1 à 192,7+ semaines).
Chez les patients traités par nivolumab en association à l'ipilimumab (avec ou
sans chimiothérapie), l'incidence des éruptions cutanées était de 46,2 % (968/2
094). Des cas de Grade 2, Grade 3 et Grade 4 ont été rapportés chez
respectivement 14,1 % (296/2 094), 4,6 % (97/2 094) et < 0,1 % (2/2 094) des
patients. Le délai médian de survenue était de 0,7 mois (de 0,0 à 33,8 mois).
Une résolution est survenue chez 671 patients (69,6 %) avec un délai médian de
résolution de 11,1 semaines (de 0,1 à 268,7+ semaines). Chez les patients
traités par nivolumab 1 mg/kg en association à l'ipilimumab 3 mg/kg,
l'incidence des éruptions cutanées était de 65,2 %, avec des cas de Grade 2
(20,3 %) et de Grade 3 (7,8 %).
Chez les patients traités par nivolumab en association à une chimiothérapie,
l'incidence des éruptions cutanées était de 24,1 % (306/1 268). Des cas de
Grade 2 et Grade 3 ont été rapportés chez respectivement 6,4 % (81/1 268) et
2,4 % (31/1 268) des patients. Le délai médian de survenue était de 6,6
semaines (de 0,1 à 97,4 semaines). Une résolution est survenue chez 205
patients (67,0 %) avec un délai médian de résolution de 13,6 semaines (de 0,1 à
188,1+ semaines).
Chez les patients traités par nivolumab en association au cabozantinib,
l'incidence d'éruption cutanée était de 62,8 % (201/320). Des cas d'éruption
cutanée de Grade 2 et Grade 3 ont été rapportées chez respectivement 23,1 %
(74/320) et 10,6 % (34/320) des patients. Le délai médian de survenue était de
6,14 semaines (de 0,1 à 104,4 semaines). Une résolution est survenue chez 137
patients (68,2 %) avec un délai médian de résolution de 18,1 semaines (de 0,1 à
130,6+ semaines).
De rares cas de SJS et de NET dont certains d'issue fatale ont été observés
(voir rubriques Posologie et mode d'administration et Mises en garde
spéciales et précautions d'emploi).
Réactions à la perfusion
Chez les patients traités par nivolumab en monothérapie, l'incidence des hypersensibilités/réactions à
la perfusion était de 4,0 % (188/4 646), incluant 9 cas de Grade 3 et 3 cas de Grade 4.
Chez les patients traités par nivolumab en association à l'ipilimumab (avec ou
sans chimiothérapie), l'incidence des hypersensibilités/réactions à la
perfusion était de 4,9 % (103/2 094). Des cas de Grade 1, Grade 2, Grade 3 et
Grade 4 ont été rapportés chez respectivement 2,1 % (44/2 094), 2,5 % (53/2
094), 0,2 % (5/2 094) et < 0,1 % (1/2 094) des patients. Chez les patients
présentant un MPM traités par nivolumab 3 mg/kg en association à l'ipilimumab 1
mg/kg, l'incidence des hypersensibilités/réactions à la perfusion était de 12
%.
Chez les patients traités par nivolumab en association à une chimiothérapie,
l'incidence des hypersensibilités/réactions liées à la perfusion était de 9,8 %
(124/1 268). Des cas de Grade 2, Grade 3, et Grade 4 ont été rapportés chez
respectivement 5,7 % (72/1 268), 1,4 % (18/1 268), et 0,2 % (3/1 268) des
patients.
Chez les patients traités par nivolumab en association au cabozantinib,
l'incidence des hypersensibilités/réactions à la perfusion était de 2,5 %
(8/320). L'ensemble des 8 patients présentaient des effets indésirables de
sévérité de Grade 1 ou 2. Les cas d'effets indésirables de Grade 2 étaient
rapportés chez 0,3 % (1/320) des patients.
Complications d'une greffe allogénique de cellules souches hématopoïétiques
(GCSH) dans le lymphome de Hodgkin classique
L'apparition rapide de GVHD a été rapportée avec l'utilisation de nivolumab
avant et après une GCSH allogénique (voir rubrique Mises en garde spéciales
et précautions d'emploi ).
Chez 62 patients évalués dans deux études dans le LHc ayant reçu une GCSH
allogénique après arrêt de nivolumab en monothérapie, une GVHD aiguë de Grade
3-4 a été observée chez 17/62 (27,4 %) des patients. Une GVHD hyperaiguë,
définie comme une GVHD aiguë survenant dans les 14 jours après l'injection de
cellules souches, a été rapportée chez quatre patients (6 %). Un syndrome
fébrile nécessitant des stéroïdes, sans cause infectieuse identifiée, a été
rapporté chez six patients (12 %) dans les 6 premières semaines
post-transplantation. Une corticothérapie a été instaurée chez quatre patients,
et trois patients ont répondu aux stéroïdes. Une maladie veino-occlusive
hépatique est survenue chez deux patients, dont l'un est décédé d'une GVHD et
d'une défaillance multiviscérale. Dix-neuf des 62 patients (30,6 %) sont
décédés de complications de GCSH allogénique après nivolumab. Les 62 patients
ont eu un suivi médian de 38,5 mois (de 0 à 68 mois) à partir de la GCSH.
Élévation des enzymes hépatiques lorsque nivolumab est associé au
cabozantinib dans le CCR
Les données d'étude clinique chez des patients atteints de CCR n'ayant pas reçu
de traitement au préalable et recevant du nivolumab en association au
cabozantinib, ont montré une incidence plus élevée d'augmentation des taux ALAT
(10,1 %) et des taux d'ASAT (8,2 %) de Grade 3 et Grade 4, comparé au nivolumab
administré en monothérapie chez les patients atteints de CCR avancé. Chez les
patients dont l'augmentation des taux d'ALAT ou d'ASAT était de Grade ≥ 2
(n = 85) : le délai médian de survenue était de 10,1 semaines (de 2,0 à 106,6
semaines), 26 % recevaient des corticoïdes pendant une durée médiane de 1,4
semaines (de 0,9 à 75,3 semaines), et une résolution de la sévérité jusqu'à un
Grade 0-1 est survenue chez 91 % des patients avec un délai médian de résolution
de 2,3 semaines (de 0,4 à 108,1+ semaines). Parmi les 45 patients présentant
une augmentation des taux d'ALAT ou d'ASAT de Grade ≥ 2, qui ont reçu à
nouveau soit nivolumab (n = 10) soit cabozantinib (n = 10) administrés en
monothérapie ou en association (n = 25), une réapparition de l'augmentation des
taux d'ALAT ou d'ASAT de Grade ≥ 2 a été observée chez 3 patients
recevant OPDIVO, 4 patients recevant cabozantinib et 8 patients recevant
l'association OPDIVO et cabozantinib.
Anomalies des valeurs biologiques
Chez les patients traités par nivolumab en monothérapie, la proportion de patients ayant présenté une
modification des paramètres biologiques par rapport à l'inclusion vers une anomalie de Grade 3 ou 4 a
été la suivante : 3,4 % pour les anémies (toutes de Grade 3), 0,7 % pour les thrombopénies, 0,7 % pour
les leucopénies, 8,7 % pour les lymphopénies, 0,9 % pour les neutropénies, 1,7 % pour les
augmentations du taux de phosphatases alcalines, 2,6 % pour les augmentations du taux d’ASAT,
2,3 % pour les augmentations du taux d’ALAT, 0,8 % pour les augmentations du taux de bilirubine
totale, 0,7 % pour les augmentations du taux de créatinine, 2,0 % pour les hyperglycémies, 0,7 % pour
les hypoglycémies, 3,8 % pour les augmentations de l’amylase, 6,9 % pour les augmentations de la
lipase, 4,7 % pour les hyponatrémies, 1,6 % pour les hyperkaliémies, 1,3 % pour les hypokaliémies,
1,1 % pour les hypercalcémies, 0,6 % pour les hypermagnésémies, 0,4 % pour les hypomagnésémies,
0,6 % pour les hypocalcémies, 0,6 % pour les hypoalbuminémies et < 0,1 % pour les hypernatrémies.
Chez les patients traités par nivolumab en association à l'ipilimumab (avec ou
sans chimiothérapie), la proportion des patients ayant présenté une aggravation
des paramètres biologiques par rapport à l'inclusion vers une anomalie de Grade
3 ou 4 a été la suivante : 4,9 % pour les anémies, 1,5 % pour les
thrombopénies, 2,3 % pour les leucopénies, 7,3 % pour les lymphopénies, 3,4 %
pour les neutropénies, 2,9 % pour les augmentations du taux de phosphatases
alcalines, 7,3 % pour les augmentations du taux d'ASAT, 8,4 % pour les
augmentations du taux d'ALAT, 1,2 % pour les augmentations du taux de
bilirubine totale, 1,6 % pour les augmentations du taux de créatinine, 5,8 %
pour les hyperglycémies, 8,4 % pour les augmentations de l'amylase, 16,7 % pour
l'augmentation de la lipase, 0,8 % pour les hypocalcémies, 0,2 % pour les
hypernatrémies, 1,0 % pour les hypercalcémies, 1,9 % pour les hyperkaliémies,
0,5 % pour les hypermagnésémies, 3,4 % pour les hypokaliémies et 9,8 % pour les
hyponatrémies.
Chez les patients traités par nivolumab 1 mg/kg en association à l'ipilimumab 3
mg/kg, une plus grande proportion de patients a présenté une aggravation de
l'augmentation du taux d'ALAT par rapport à l'inclusion, passant à un Grade 3
ou 4 (15,3 %).
Chez les patients traités par nivolumab en association à une chimiothérapie, la
proportion des patients ayant présenté une aggravation des paramètres
biologiques par rapport à l'inclusion vers une anomalie de Grade 3 ou 4 a été
la suivante : 14,5 % pour les anémies, 5,4 % pour les thrombopénies, 10,7 %
pour les leucopénies, 14,0 % pour les lymphopénies, 25,7 % pour les
neutropénies, 2,4 % pour les augmentations du taux de phosphatases alcalines,
3,6 % pour les augmentations du taux d'ASAT, 2,7 % pour les augmentations du
taux d'ALAT, 1,9 % pour les augmentations du taux de bilirubine totale, 1,2 %
pour les augmentations du taux de créatinine, 4,6 % pour les augmentations de
l'amylase, 5,6 % pour l'augmentation de la lipase, 0,5 % pour les
hypernatrémies, 7,8 % pour les hyponatrémies, 1,6 % pour les hyperkaliémies,
6,4 % pour les hypokaliémies, 0,9 % pour les hypercalcémies, 1,8 % pour les
hypocalcémies, 1,7 % pour les hypomagnésémies, 3,4 % pour les hyperglycémies, et
0,6 % pour les hypoglycémies.
Chez les patients traités par nivolumab en association au cabozantinib, la
proportion de patients ayant présenté une aggravation des paramètres
biologiques par rapport à l'inclusion jusqu'à une anomalie de Grade 3 et 4 a
été la suivante : 3,5 % pour les anémies (toutes de Grade 3), 0,3 % pour les
thrombopénies, 0,3 % pour les leucopénies, 7,5 % pour les lymphopénies, 3,5 %
pour les neutropénies, 3,2 % pour les augmentations du taux de phosphatases
alcalines, 8,2 % pour les augmentations du taux d'ASAT, 10,1 % pour les
augmentations du taux d'ALAT, 1,3 % pour les augmentations du taux de
bilirubine totale, 1, 3% pour les augmentations du taux de créatinine, 11,9 %
pour les augmentations de l'amylase, 15,6 % pour les augmentations de la
lipase, 3,5 % pour les hyperglycémies, 0,8 % pour les hypoglycémies, 2,2 % pour
les hypocalcémies, 0,3 % pour les hypercalcémies, 5,4 % pour les
hyperkaliémies, 4,2 % pour les hypermagnésémies, 1,9 % pour les
hypomagnésémies, 3,2 % pour les hypokaliémies, 12,3 % pour les hyponatrémies et
21,2 % pour les hypophosphatémies.
Immunogénicité
Parmi les 3 529 patients traités par nivolumab en monothérapie à la dose de 3
mg/kg ou 240 mg toutes les 2 semaines, et évaluables pour la présence
d'anticorps-anti-médicament, 328 patients (9,3 %) étaient positifs au test de
détection d'anticorps anti-médicaments avec 21 patients (0,6 %) testés positifs
pour des anticorps neutralisants.
La co-administration avec une chimiothérapie n'a pas eu d'influence sur l'immunogénicité
de nivolumab. Parmi les patients traités par nivolumab 240 mg toutes les 2
semaines ou 360 mg toutes les 3 semaines en association à une chimiothérapie,
et évaluables pour la présence d'anticorps anti-médicament, 7,5 % étaient
positifs au test de détection d'anticorps anti-médicament avec 0,5 % testés
positifs pour des anticorps neutralisants.
Chez les patients traités par nivolumab en association à l'ipilimumab et
évaluables pour la présence d'anticorps anti-nivolumab, l'incidence des
anticorps anti-nivolumab était de 26,0 % avec nivolumab 3 mg/kg et ipilimumab 1
mg/kg toutes les 3 semaines, 24,9 % avec nivolumab 3 mg/kg toutes les 2
semaines et ipilimumab 1 mg/kg toutes les 6 semaines, et de 37,8 % avec
nivolumab 1 mg/kg et ipilimumab 3 mg/kg toutes les 3 semaines. L'incidence des
anticorps neutralisants dirigés contre nivolumab était de 0,8% avec nivolumab 3
mg/kg et ipilimumab 1 mg/kg toutes les 3 semaines, 1,5 % avec nivolumab 3mg/kg
toutes les 2 semaines et ipilimumab 1 mg/kg toutes les 6 semaines, et de 4,6 %
avec nivolumab 1 mg/kg et ipilimumab 3 mg/kg toutes les 3 semaines. Chez les
patients pour lesquels il était possible d'évaluer la présence des anticorps
anti-ipilimumab, l'incidence des anticorps anti-ipilimumab allait de 6,3 à 13,7
%, et celle des anticorps neutralisants dirigés contre ipilimumab allait de 0 à
0,4 %.
Chez les patients traités par nivolumab en association à l'ipilimumab et à une
chimiothérapie et évaluables pour la présence d'anticorps anti-nivolumab ou
d'anticorps neutralisants dirigés contre le nivolumab, l'incidence des
anticorps anti-nivolumab était de 33,8 % et l'incidence des anticorps
neutralisants était de 2,6 %. Chez les patients traités par nivolumab en
association à l'ipilimumab et à une chimiothérapie et évaluables pour la
présence des anticorps anti-ipilimumab ou d'anticorps neutralisants dirigés
contre l'ipilimumab, l'incidence des anticorps anti-ipilimumab était de 7,5 %
et celle des anticorps neutralisants dirigés contre l'ipilimumab était de 1,6
%.
Bien que la clairance de nivolumab ait été augmentée de 20 % lorsque les
anticorps anti-nivolumab étaient présents, il n'a pas été mis en évidence de
perte d'efficacité ou d'altération du profil de toxicité avec la présence
d'anticorps nivolumab, basé sur les analyses de pharmacocinétique et de
dose-réponse pour les deux traitements en monothérapie et en association.
Population pédiatrique
La sécurité du nivolumab en monothérapie (3 mg/kg toutes les 2 semaines) et en association avec
l’ipilimumab (nivolumab 1 mg/kg ou 3 mg/kg en association avec l’ipilimumab 1 mg/kg toutes les
3 semaines pour les 4 premières doses, suivi de nivolumab 3 mg/kg en monothérapie toutes les
2 semaines) a été évaluée chez 97 patients pédiatriques âgés de ≥ 1 an à < 18 ans (dont 53 patients
âgés de 12 à < 18 ans) présentant des tumeurs hématologiques ou solides récidivantes ou réfractaires,
incluant le mélanome avancé, dans le cadre de l’étude clinique CA209070. Chez les patients
pédiatriques, le profil de sécurité a été généralement comparable à celui observé chez les adultes
traités par nivolumab en monothérapie ou en association avec l’ipilimumab. Aucun nouveau signal de
sécurité n’a été identifié. Les données de sécurité à long terme ne sont pas disponibles pour
l’utilisation du nivolumab chez les adolescents âgés de 12 ans et plus.
Les effets indésirables les plus fréquents, rapportés chez au moins 20 % des patients pédiatriques
traités par nivolumab en monothérapie, ont été une fatigue (35,9 %) et une diminution de l’appétit
(21,9 %). La majorité des effets indésirables rapportés pour le nivolumab en monothérapie étaient de
Grade 1 ou 2. Vingt et un patients (33 %) ont présenté au moins un effet indésirable de Grade 3 ou 4.
Les effets indésirables les plus fréquents, rapportés chez au moins 20 % des patients pédiatriques
traités par nivolumab en association avec l’ipilimumab, ont été une fatigue (33,3 %) et une éruption
cutanée maculopapuleuse (21,2 %). La majorité des effets indésirables rapportés pour le nivolumab en
association avec l’ipilimumab étaient de Grade 1 ou 2. Dix patients (30 %) ont présenté au moins un
effet indésirable de Grade 3 ou 4.
Aucun nouveau signal de sécurité n'a été identifié dans l'étude clinique
CA209908 sur les 151 patients pédiatriques présentant des tumeurs primitives du
système nerveux central (SNC) de haut grade (voir rubrique Propriétés
pharmacodynamiques), comparé aux données disponibles dans les études menées
dans toutes les indications chez l'adulte.
Patients âgés
Aucune différence globale de tolérance n'a été rapportée entre les patients
âgés (≥ 65 ans) et les patients plus jeunes (< 65 ans). Les données
des patients âgés de 75 ans ou plus dans le SCCHN, le mélanome adjuvant et le
CO ou le CJOG adjuvant sont trop limitées pour tirer des conclusions danscette
population (voir rubrique Propriétés pharmacodynamiques). Les données
des patients âgés de 75 ans ou plus dans le CRC dMMR ou MSI-H sont limitées
(voir rubrique Propriétés pharmacodynamiques). Les données des patients
âgés de 65 ans ou plus dans le LHc sont trop limitées pour tirer des
conclusions dans cette population (voir rubrique Propriétés
pharmacodynamiques). Dans le MPM, il y a eu un taux plus important d'effets
indésirables graves et d'arrêts de traitement dus à un effet indésirable chez
les patients âgés de 75 ans ou plus (68 % et 35 % respectivement) comparé à
tous les patients ayant reçu du nivolumab en association à l'ipilimumab (54 %
et 28 % respectivement). Chez les patients traités par nivolumab en association
au cabozantinib, les données chez les patients âgés de 75 ans ou plus dans le
CCR sont trop limitées pour tirer des conclusions dans cette population (voir rubrique
Propriétés pharmacodynamiques).
Insuffisance hépatique ou rénale
Dans l'étude clinique dans le CBNPC de type non-épidermoïde (CA209057), le
profil de tolérance chez les patients présentant une insuffisance rénale ou
hépatique à l'inclusion était comparable à celui de la population globale. Ces
résultats doivent être interprétés avec précaution en raison de la petite
taille de l'échantillon dans les sous-groupes.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du
médicament est importante. Elle permet une surveillance continue du rapport
bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet
indésirable suspecté via le système national de déclaration - voir Annexe
V.
Adénocarcinome gastrique, de la jonction œso-gastrique (JOG) ou de l'œsophage :
Lors de l'évaluation du statut PD-L1 de la tumeur, choisir une méthodologie validée et robuste. SURVEILLANCE du traitement :
- Apparition de signes et symptômes de pneumopathie inflammatoire, tels que des modifications radiologiques (ex : opacités focales en verre dépoli, infiltrats localisés), dyspnée et hypoxie.
- Apparition de diarrhées et d'autres symptômes de colites, tels que des douleurs abdominales et la présence de mucus ou de sang dans les selles.
- Apparition de signes et symptômes d'hépatite, tels que des augmentations des transaminases et de la bilirubine totale.
- Apparition de signes et symptômes de néphrite ou d'atteinte rénale.
- Apparition de signes et symptômes d'endocrinopathie, et des modifications de la fonction thyroïdienne (au début du traitement, à intervalles réguliers durant le traitement, et si indiqué cliniquement).
PRÉVENIR le patient que des effets indésirables liés au traitement peuvent survenir jusqu'à 5 mois après la dernière perfusion de nivolumab.
CONSEILLER les patientes en âge de procréer d'utiliser une méthode efficace de contraception pendant toute la durée du traitement et pendant 5 mois après la dernière perfusion de nivolumab.
Précaution concernant les patients sous traitement néoadjuvant du CNBPC : Les patients présentant un score de performance initial ≥ 2, une maladie auto-immune active, une pneumopathie interstitielle diffuse symptomatique, des conditions médicales nécessitant une immunosuppression systémique, une maladie non résécable ou métastatique, qui ont reçu un traitement anticancéreux antérieur pour une maladie résécable ou qui présentaient des mutations connues de l'EGFR ou des translocations connues ALK ont été exclus de l'étude pivot dans le traitement néoadjuvant du CBNPC résécable. En l'absence de données, le nivolumab en association à une chimiothérapie doit être utilisé avec précaution dans ces populations, après évaluation attentive du bénéfice/risque potentiel au cas par cas.
Grossesse
Aucune donnée sur l'utilisation de nivolumab n'est
disponible chez la femme enceinte. Les études effectuées chez l'animal ont mis
en évidence une toxicité embryofœtale (voir
rubrique Données de sécurité préclinique). L'IgG4 humaine est connue
pour traverser la barrière placentaire et nivolumab
est une IgG4 ; par conséquent, il existe un risque potentiel de transmission de
nivolumab
de la mère vers le fœtus. L'utilisation de nivolumab
n'est pas recommandée chez la femme enceinte ou en âge de procréer n'utilisant
pas de méthode efficace de contraception, à moins que le bénéfice clinique
attendu ne dépasse le risque potentiel. Une méthode efficace de contraception
doit être utilisée pendant toute la durée du traitement et poursuivie pendant 5
mois après la dernière perfusion de nivolumab.
Allaitement
On ne sait pas si nivolumab est excrété dans le lait
maternel. Etant donné que de nombreux médicaments, y compris les anticorps,
peuvent être excrétés dans le lait humain, un risque pour les
nouveau-nés/nourrissons ne peut être exclu. Une décision doit être prise soit
d'interrompre l'allaitement soit d'interrompre le traitement par nivolumab
en prenant en compte le bénéfice de l'allaitement pour l'enfant au regard du
bénéfice du traitement pour la femme.
Fertilité
Les études permettant d'évaluer l'effet de nivolumab
sur la fertilité n'ont pas été effectuées. En conséquence, l'effet de nivolumab
sur la fertilité masculine et féminine n'est pas connu.
Nivolumab est un anticorps monoclonal humain, en conséquence aucune étude pharmacocinétique d'interaction n'a été réalisée. Les anticorps monoclonaux humains n'étant pas métabolisés par les enzymes du cytochrome P450 (CYP) ou d'autres enzymes métabolisant les médicaments, l'inhibition ou l'induction de ces enzymes lors de la co-administration de médicaments ne devraient pas entraîner de modification des paramètres pharmacocinétiques de nivolumab.
Autres formes d'interactions
Immunosuppression systémique
L'utilisation au
préalable de corticoïdes systémiques et d'autres immunosuppresseurs
doit être évitée avant de commencer nivolumab, du fait de leur
interférence potentielle avec l'activité pharmacodynamique. Cependant,
les corticoïdes systémiques et d'autres agents immunosuppresseurs
peuvent être utilisés après l'initiation de nivolumab pour traiter les
effets indésirables d'origine immunologique. Les résultats
préliminaires montrent qu'une immunosuppression systémique après le
début du traitement par nivolumab ne semble pas empêcher la réponse au
nivolumab.
Le traitement doit être instauré et surveillé par un médecin expérimenté dans le traitement du cancer.
Test PD-L1
Si cela est spécifié dans l'indication, la sélection des patients pour
le traitement par OPDIVO basée sur l'expression tumorale de PD-L1 doit
être confirmée par un test validé (voir rubriques Indications thérapeutiques, Mises en garde spéciales et précautions d'emploi, Effets indesirables et Propriétés pharmacodynamiques).
Posologie
OPDIVO en
monothérapie
La dose recommandée d'OPDIVO est soit de 240 mg de nivolumab toutes les 2 semaines, soit de
480 mg toutes les 4 semaines en fonction de l’indication et de la population (voir rubriques Propriétés pharmacodynamiques et Propriétés pharmacocinétiques),
comme présenté dans le Tableau 1.
Tableau 1 : Dose recommandée et temps
de perfusion pour l'administration intraveineuse de nivolumab en monothérapie
|
Indication*
|
Dose recommandée et temps de
perfusion
|
|
Mélanome (avancé ou traitement adjuvant) |
Adultes et adolescents (âgés de 12 ans et plus et pesant au moins 50 kg) : 240 mg toutes les 2 semaines pendant 30 minutes ou 480 mg toutes les 4 semaines pendant 60 minutes ou pendant 30 minutes (mélanome adjuvant, voir rubrique Propriétés pharmacodynamiques) |
| Adolescents (âgés de 12 ans et plus et pesant moins de
50 kg) : 3 mg/kg toutes les 2 semaines pendant 30 minutes ou 6 mg/kg toutes les 4 semaines pendant 60 minutes |
|
|
Carcinome à cellules rénales
Carcinome urothélial infiltrant le muscle (CUIM) (traitement adjuvant) |
240 mg toutes les 2 semaines
pendant 30 minutes ou 480 mg toutes les 4 semaines pendant 60 minutes |
|
Cancer de l'œsophage ou de la
jonction œso-gastrique (traitement adjuvant) |
240 mg toutes les 2 semaines
pendant 30 minutes ou
480 mg toutes les 4 semaines pendant 30 minutes les 16 premières semaines, suivi de 480 mg toutes les 4 semaines pendant 30 minutes |
|
Cancer bronchique non à petites cellules Lymphome de Hodgkin classique Cancer épidermoïde de la tête et du cou Carcinome urothélial Carcinome épidermoïde de l'œsophage |
240 mg toutes les 2 semaines pendant 30 minutes |
* Conformément à l'indication en
monothérapie en rubrique Indications thérapeutiques.
S'il est nécessaire de faire passer des patients atteints de mélanome, de CCR, de CO, de CJOG ou de CUIM (traitement ajuvant) du schéma posologique à 240 mg toutes les 2 semaines au schéma posologique à 480 mg toutes les 4 semaines, la première dose à 480 mg doit être administrée deux semaines après la dernière dose à 240 mg. A l'inverse, s'il est nécessaire de faire passer des patients du schéma posologique à 480 mg toutes les 4 semaines au schéma posologique à 240 mg toutes les 2 semaines, la première dose à 240 mg doit être administrée quatre semaines après la dernière dose à 480 mg.
OPDIVO en association à l'ipilimumab
Mélanome
Chez les adultes et les adolescents âgés de 12 ans et plus et pesant au moins 50 kg, la dose
recommandée est de 1 mg/kg de nivolumab en association avec 3 mg/kg d’ipilimumab, administrée en
perfusion intraveineuse, toutes les 3 semaines pour les 4 premières doses. Ceci est ensuite suivi par
une seconde phase durant laquelle nivolumab en monothérapie est administré par voie intraveineuse,
soit à 240 mg toutes les 2 semaines, soit à 480 mg toutes les 4 semaines (voir rubriques Propriétés pharmacodynamiques et Propriétés pharmacocinétiques),
comme présenté dans le Tableau 2. Pour la phase en monothérapie, la première dose de nivolumab
doit être administrée :
▪
3 semaines après la dernière dose en association de
nivolumab et ipilimumab, en cas d'administration de la dose à 240
mg toutes les 2 semaines ; ou
▪ 6 semaines après la dernière dose en association de
nivolumab et ipilimumab, en cas d'administration de la dose à 480
mg toutes les 4 semaines.
Chez les adolescents âgés de 12 ans et plus et pesant moins de 50 kg, la dose recommandée est de
1 mg/kg de nivolumab en association avec 3 mg/kg d’ipilimumab, administrée par voie intraveineuse,
toutes les 3 semaines pour les 4 premières doses. Ceci est ensuite suivi par une seconde phase durant
laquelle nivolumab en monothérapie est administré par voie intraveineuse, soit à 3 mg/kg toutes les
2 semaines, soit à 6 mg/kg toutes les 4 semaines (voir rubriques Propriétés pharmacodynamiques et Propriétés pharmacocinétiques), comme présenté dans le
Tableau 2. Pour la phase en monothérapie, la première dose de nivolumab doit être administrée :
▪ 3 semaines après la dernière dose en association de nivolumab et ipilimumab, en cas
d’administration de la dose à 3 mg/kg toutes les 2 semaines ; ou
▪ 6 semaines après la dernière dose en association de nivolumab et ipilimumab, en cas
d’administration de la dose à 6 mg/kg toutes les 4 semaines.
Tableau 2 : Doses recommandées et
temps de perfusion pour l'administration intraveineuse de nivolumab en association à l'ipilimumab dans le mélanome
|
Phase en association, toutes les 3 semaines pour 4 cycles d'administration |
Phase en monothérapie
|
|
| Nivolumab | Adultes et adolescents âgés
de 12 ans et plus : 1 mg/kg pendant 30 minutes |
Adultes et adolescents (âgés de 12 ans et plus et pesant au
moins 50 kg) : 240 mg toutes les 2 semaines pendant 30 minutes - ou 480 mg toutes les 4 semaines pendant 60 minutes Adolescents (âgés de 12 ans et plus et pesant moins de 50 kg) : 3 mg/kg toutes les 2 semaines pendant 30 minutes ou 6 mg/kg toutes les 4 semaines pendant 60 minutes |
| Ipilimumab | Adultes et adolescents âgés
de 12 ans et plus : 3 mg/kg pendant 30 minutes |
- |
Mésothéliome pleural malin
La dose recommandée est de 360 mg de nivolumab
administrée par voie intraveineuse pendant 30 minutes toutes les 3 semaines, en
association avec 1 mg/kg d'ipilimumab administrée par
voie intraveineuse pendant 30 minutes toutes les 6 semaines. Le traitement est
poursuivi jusqu'à 24 mois chez les patients sans progression de la maladie.
Carcinome à cellules
rénales (CCR) et cancer colorectal (CRC) dMMR ou
MSI-H
La dose recommandée est de 3 mg/kg de nivolumab en
association avec 1 mg/kg d'ipilimumab, administré par
voie intraveineuse, toutes les 3 semaines pour les 4 premières doses. Ceci est
ensuite suivi par une seconde phase durant laquelle nivolumab
en monothérapie est administré par voie intraveineuse soit à 240 mg toutes les
2 semaines soit à 480 mg toutes les 4 semaines (CCR uniquement), comme présenté
dans le Tableau 3. Pour la phase en monothérapie, la première dose de nivolumab doit être administrée :
● 3 semaines après la dernière dose en association de nivolumab et ipilimumab, en cas
d'administration de la dose à 240 mg toutes les 2 semaines ; ou
● 6 semaines après la dernière dose en association de nivolumab et ipilimumab, en cas
d'administration de la dose à 480 mg toutes les 4 semaines (CCR uniquement).
Tableau 3 :
Doses recommandées et temps de perfusion pour l'administration par voie
intraveineuse de nivolumab
en association à l'ipilimumab
dans le CCR
|
Phase en association, toutes les 3 semaines pour 4 cycles d'administration |
Phase de monotherapie | |
| Nivolumab |
3 mg/kg pendant 30 minutes |
240 mg toutes les 2 semaines
pendant 30 minutes ou 480 mg toutes les 4 semaines pendant 60 minutes (CCR uniquement) |
| Ipilimumab |
1 mg/kg pendant 30 minutes |
- |
Carcinome épidermoïde de l'œsophage
La dose recommandée est soit de 3 mg/kg de nivolumab toutes les 2 semaines, soit de 360 mg de
nivolumab toutes les 3 semaines administré par voie intraveineuse pendant 30 minutes, en association
avec 1 mg/kg d'ipilimumab administré par voie intraveineuse pendant 30 minutes toutes les
6 semaines. Le traitement est recommandé jusqu'à progression de la maladie, toxicité inacceptable ou
jusqu'à 24 mois chez les patients sans progression de la maladie.
OPDIVO en
association au cabozantinib
Carcinome à cellules rénales
La dose recommandée de nivolumab,
administré par voie intraveineuse, est soit de 240 mg toutes les 2
semaines, soit de 480 mg toutes les 4 semaines, en association avec 40
mg de cabozantinib
administré par voie orale une fois par jour.
Tableau 4 : Doses recommandées et
temps de perfusion pour l'administration par voie intraveineuse de nivolumab en association au cabozantinib par voie orale dans
le CCRet le CRC dMMR ou MSI-H
|
|
Phase d'association
|
|
Nivolumab |
240 mg toutes les 2 semaines
pendant 30 minutes ou
480 mg toutes les 4 semaines pendant 60 minutes |
|
Cabozantinib |
40 mg une fois par jour |
OPDIVO en association à l'ipilimumab et la chimiothérapie
Cancer
bronchique non à petites cellules
La dose recommandée est de 360 mg de nivolumab,
administrée par voie intraveineuse pendant 30 minutes toutes les 3 semaines, en
association avec 1 mg/kg d'ipilimumab,
administré par voie intraveineuse pendant 30 minutes toutes les 6 semaines, et
une chimiothérapie à base de sels de platine administrée toutes les 3 semaines.
Après 2 cycles de chimiothérapie, le traitement est poursuivi à la dose de 360
mg de nivolumab,
administrée par voie intraveineuse toutes les 3 semaines, en association avec 1
mg/kg d'ipilimumab toutes
les 6 semaines. Le traitement est recommandé jusqu'à progression de la maladie,
toxicité inacceptable ou jusqu'à 24 mois chez les patients sans progression de la maladie.
OPDIVO en association à une chimiothérapie
Traitement néoadjuvant du cancer bronchique non à petites cellules
La dose recommandée est de 360 mg de nivolumab, administrée par voie intraveineuse pendant
30 minutes, en association à une chimiothérapie à base de sels de platine toutes les 3 semaines pendant
3 cycles (voir rubrique Propriétés pharmacodynamiques).
Carcinome épidermoïde de l'œsophage
La dose recommandée de nivolumab est de 240 mg toutes les 2 semaines ou 480 mg toutes les
4 semaines administré par voie intraveineuse pendant 30 minutes en association à une chimiothérapie
combinée à base de fluoropyrimidine et de sels de platine (voir rubrique Propriétés pharmacodynamiques ). Le traitement par
nivolumab est recommandé jusqu'à progression de la maladie, toxicité inacceptable, ou jusqu'à
24 mois chez les patients sans progression de la maladie.
Adénocarcinome gastrique, de la jonction œso-gastrique ou de l'œsophage
La dose recommandée est de 360 mg de nivolumab, administrée par voie
intraveineuse pendant 30 minutes, en association à une chimiothérapie
combinée à base de fluoropyrimidine et de sels de platine, administrés
toutes les 3 semaines ou 240
mg de nivolumab, administrée par voie intraveineuse pendant 30 minutes,
en association à une chimiothérapie combinée à base de fluoropyrimidine
et de sels de platine, administrés toutes les 2 semaines (voir rubrique
Propriétés pharmacodynamiques).
Le traitement par nivolumab est recommandé jusqu'à progression de la
maladie, toxicité inacceptable ou jusqu'à 24 mois sans progression de
la maladie.
Durée du traitement
Le traitement par OPDIVO, que ce soit en monothérapie ou en association à l'ipilimumabou ou à
d'autres agents thérapeutiques , doit être poursuivi
tant qu'un bénéfice clinique est observé ou jusqu'à ce que le patient ne puisse
plus tolérer le traitement (et jusqu'à la durée maximale du traitement si
celle-ci est spécifiée pour l'indication).
Pour le traitement en adjuvant, la durée maximale du traitement avec OPDIVO est de 12 mois.
Lorsqu'OPDIVO est administré en association au cabozantinib, le traitement par OPDIVO doit être poursuivi jusqu'à progression de la maladie, toxicité inacceptable ou jusqu'à 24 mois chez les patients sans progression de la maladie. Le traitement par cabozantinib doit être poursuivi jusqu'à progression de la maladie ou toxicité inacceptable. Pour plus d'informations, se référer au Résumé des Caractéristiques du Produit (RCP) du cabozantinib.
Des réponses atypiques (c'est-à-dire une augmentation initiale transitoire de la taille de la tumeur ou l'apparition de nouvelles petites lésions au cours des premiers mois, suivi de réduction de la tumeur) ont été observées. Il est recommandé de continuer le traitement par nivolumab ou nivolumab en association à l'ipilimumab chez les patients cliniquement stables présentant des signes initiaux de progression de la maladie jusqu'à ce que la progression de la maladie soit confirmée.
Les augmentations ou diminutions de doses ne sont pas recommandées lorsqu'OPDIVO est administré en monothérapie ou en association à d'autres agents thérapeutiques. Des administrations différées ou des interruptions de traitement peuvent être nécessaires selon la tolérance individuelle et la tolérabilité au traitement. Les recommandations concernant l'arrêt définitif du traitement ou la suspension des doses sont décrites dans le Tableau 5. Des recommandations détaillées de la prise en charge des effets indésirables d'origine immunologique sont décrites à la rubrique Mises en garde spéciales et précautions d'emploi. Lorsque nivolumab est administré en association à d'autres agents thérapeutiques, se référer aux RCP de ces agents thérapeutiques en ce qui concerne les posologies.
Tableau 5 : Recommandations de
modification du traitement par OPDIVO ou OPDIVO en association
|
Effet
indésirable
d'origine
immunologique |
Sévérité |
Modification de traitement |
|
Pneumopathie inflammatoire d'origine immunologique |
Pneumopathie de Grade 2 Pneumopathie de Grade 3 ou 4 |
Suspendre la(les) dose(s) jusqu'à
la résolution des symptômes, l'amélioration des anomalies radiographiques, et
la fin du traitement par corticoïdes Arrêt définitif du traitement |
|
Colite d'origine immunologique |
Diarrhée ou colite de Grade 2 Diarrhée ou colite de Grade 3 -OPDIVO en monothérapie -OPDIVO + ipilimumaba Diarrhée ou colite de Grade 4 |
Suspendre la(les) dose(s) jusqu'à
la résolution des symptômes et la fin du traitement par corticoïdes, s'il
s'est avéré nécessaire Suspendre la(les) dose(s) jusqu'à la résolution des symptômes et la fin du traitement par corticoïdes Arrêt définitif du traitement Arrêt définitif du traitement |
|
Hépatite d'origine immunologique NOTE : chez les patients atteints de CCR traités par OPDIVO en association au cabozantinib et présentant une élévation enzyme hépatiques, voir les recommandations de dose présentées à la suite de ce tableau. |
Elévation de Grade 2 des aspartate
aminotransférases (ASAT),
des alanine aminotransférases
(ALAT), ou de la bilirubine totale. Elévation de Grade 3 ou 4 des ASAT, ALAT, ou de la bilirubine totale |
Suspendre la(les) dose(s) jusqu'au
retour des valeurs biologiques aux valeurs initiales et jusqu'à la fin du
traitement par corticoïdes, s'il s'est avéré nécessaire Arrêt définitif du traitement |
|
Néphrite et dysfonction rénale d'origine immunologique |
Elévation de la créatininémie de Grade 2 ou 3 Elévation de la créatininémie de Grade 4 |
Suspendre la(les) dose(s) jusqu'au
retour de la créatininémie à la valeur initiale et jusqu'à la fin du traitement par corticoïdes Arrêt définitif du traitement |
|
Endocrinopathies d'origine immunologique |
Hypothyroïdie, hyperthyroïdie, hypophysite symptomatiques de Grade 2 ou 3, Insuffisance surrénalienne de Grade 2 Diabète de Grade 3 Hypothyroïdie de Grade 4 Hyperthyroïdie de Grade 4 Hypophysite de Grade 4 Insuffisance surrénalienne de Grade 3 ou 4 Diabète de Grade 4 |
Suspendre la(les) dose(s) jusqu'à
la résolution des symptômes et la fin du traitement par corticoïdes (s'il
s'est avéré nécessaire pour les symptômes d'une inflammation aiguë). Le traitement doit être maintenu en cas de traitement substitutif hormonalb tant qu'il n'y a pas de présence de symptômes Arrêt définitif du traitement |
|
Effets indésirables cutanés d'origine immunologique |
Eruption cutanée de Grade 3 Eruption cutanée de Grade 4 Syndrome de Stevens-Johnson (SJS) ou nécrolyse épidermique toxique (NET) |
Suspendre la(les) dose(s) jusqu'à
la résolution des symptômes et la fin du traitement par corticoïdes Arrêt définitif du traitement Arrêt définitif du traitement (voir rubrique Mises en garde spéciales et précautions d'emploi) |
|
Myocardite d'origine immunologique |
Myocardite de Grade 2 Myocardite de Grade 3 ou 4 |
Suspendre la(les) dose(s) jusqu'à
la résolution des symptômes et la fin du traitement par corticoïdesc Arrêt définitif du traitement |
|
Autres effets indésirables d'origine immunologique |
Grade 3 (première apparition) Grade 4 ou Grade 3 récidivant ; Grade 2 ou 3 persistant malgré une modification de traitement ; impossibilité de réduire la dose de corticoïdes à 10 mg de prednisone ou équivalent par jour |
Suspendre la(les) dose(s) Arrêt définitif du traitement |
Note : Les grades de
toxicité correspondent à la classification du National Cancer Institute
Common Terminology Criteria for Adverse Events Version 4.0 (NCI-CTCAE
v4).
a Durant la seconde phase de traitement (nivolumab en monothérapie) faisant suite au traitement en association, il est recommandé d'arrêter définitivement le traitement en cas de survenue d'une diarrhée ou d'une colite de Grade 3.
b La recommandation pour l'utilisation d'un traitement substitutif hormonal est fournie en rubrique Mises en garde spéciales et précautions d'emploi.
c La tolérance de la reprise du traitement par nivolumab ou par nivolumab en association à l'ipilimumab, chez les patients ayant présentés précédemment une myocardite d'origine immunologique, n'est pas connue.
a Durant la seconde phase de traitement (nivolumab en monothérapie) faisant suite au traitement en association, il est recommandé d'arrêter définitivement le traitement en cas de survenue d'une diarrhée ou d'une colite de Grade 3.
b La recommandation pour l'utilisation d'un traitement substitutif hormonal est fournie en rubrique Mises en garde spéciales et précautions d'emploi.
c La tolérance de la reprise du traitement par nivolumab ou par nivolumab en association à l'ipilimumab, chez les patients ayant présentés précédemment une myocardite d'origine immunologique, n'est pas connue.
OPDIVO en monothérapie ou en
association à d'autres agents thérapeutiques doit être définitivement arrêté en
cas de :
▪ Effets indésirables de Grade 4 ou de Grade 3
récidivants ;
▪ Effets indésirables de Grade 2 ou 3 persistants
malgré leur prise en charge.
Les patients traités par OPDIVO doivent recevoir la Carte d'Alerte Patient et être informés sur les risques liés à l'utilisation d'OPDIVO (voir également la notice).
Lorsqu'OPDIVO est administré en association à l'ipilimumab, si l'un des traitements est suspendu, l'autre traitement devra aussi être suspendu. Si l'administration est reprise après un temps différé, soit le traitement en association ou OPDIVO en monothérapie peut être repris sur la base de l'évaluation individuelle du patient.
Lorsqu'OPDIVO est administré en association à une chimiothérapie,
consulter le RCP des composants respectifs du traitement en association
concernant la posologie. Si l'un des traitements est
suspendu, les autres traitements peuvent être continués. Si
l'administration est reprise après un temps différé, soit le traitement
en association, OPDIVO en monothérapie ou la chimiothérapie seule peut
être repris sur la base de l'évaluation individuelle du patient.
OPDIVO en
association au cabozantinib
dans le CCR
Lorsqu'OPDIVO est administré en association au cabozantinib, les modifications de traitement
présentées ci-dessus dans le Tableau 5 s'appliquent également au traitement
OPDIVO. De plus, en ce qui concerne l'augmentation des enzymes hépatiques chez
les patients atteints de CCR traités par OPDIVO en association au cabozantinib :
• Si le taux d'ALAT ou d'ASAT est > 3 fois la LSN mais ≤
10 fois la LSN sans augmentation concomitante du taux de la bilirubine totale ≥
2 fois la LSN, OPDIVO et cabozantinib
doivent être suspendus jusqu'à ce que la sévérité de l'effet indésirable
atteigne un Grade 0-1. Une corticothérapie peut être envisagée. Après
amélioration, la reprise d'un seul traitement ou la reprise des deux
traitements peut être envisagée. Si le traitement par cabozantinib est repris, se référer au RCP du cabozantinib.
• Si le taux d'ALAT ou d'ASAT est > 10 fois la LSN ou >
3 fois la LSN avec augmentation concomitante du taux de la bilirubine totale ≥
2 fois la LSN, OPDIVO et cabozantinib
doivent être interrompus de façon définitive et une corticothérapie peut être
envisagée.
Populations particulières
Population
pédiatrique
La sécurité et l’efficacité d’OPDIVO chez les enfants âgés de moins de 18 ans n’ont pas été établies,
sauf chez les adolescents âgés de 12 ans et plus atteints d’un mélanome. Les données actuellement
disponibles d’OPDIVO en monothérapie ou en association à l’ipilimumab sont décrites aux
rubriques Posologie et mode d'administration, Effets indésirables, Propriétés pharmacodynamiques et Propriétés pharmacocinétiques.
Patients
âgés
Aucune adaptation posologique n'est nécessaire chez les patients âgés (≥
65 ans) (voir rubrique Propriétés pharmacocinétiques).
Insuffisance
rénale
Sur la base des résultats de pharmacocinétique (PK) de population, aucune
adaptation posologique n'est nécessaire chez les patients présentant une
insuffisance rénale légère ou modérée (voir rubrique Propriétés
pharmacocinétiques). Les données chez les patients présentant une insuffisance
rénale sévère sont trop limitées pour tirer des conclusions dans cette
population.
Insuffisance
hépatique
Sur la base des résultats de PK de population, aucune adaptation posologique
n'est nécessaire chez les patients présentant une insuffisance hépatique légère
(voir rubrique Propriétés pharmacocinétiques). Les données chez les
patients présentant une insuffisance hépatique modérée ou sévère sont trop
limitées pour tirer des conclusions dans ces populations. OPDIVO doit être
administré avec précaution chez les patients présentant une insuffisance
hépatique modérée (bilirubine totale > 1,5 à 3 fois la limite supérieure de
la normale [LSN], quel que soit le taux des ASAT) ou sévère (bilirubine totale
> 3 fois LSN, quel que soit le taux des ASAT).
Mode d'administration
OPDIVO doit être exclusivement administré par voie intraveineuse. Il doit être administré en perfusion intraveineuse sur une période de 30 ou 60 minutes en fonction de la posologie (voir Tableaux 1, 2, 3 et 4). La perfusion doit être administrée à l'aide d'un filtre en ligne stérile, apyrogène, à faible liaison aux protéines (diamètre des pores de 0,2 µm à 1,2 µm).
OPDIVO ne doit pas être administré en intraveineux direct ni en bolus IV.
La dose totale d'OPDIVO requise peut être perfusée directement sans dilution à la concentration de 10 mg/mL en administration intraveineuse ou peut être diluée dans une solution injectable de chlorure de sodium à 9 mg/mL (0,9 %) ou de glucose à 50 mg/mL (5 %) (voir rubrique Précautions particulières d'élimination et de manipulation).
Lorsqu'il est administré en association à l'ipilimumab et/ou à une chimiothérapie, OPDIVO doit être administré en premier suivi par l'ipilimumab (le cas échéant), puis par la chimiothérapie le même jour. Utiliser des poches et des filtres de perfusion distincts pour chaque perfusion.
Pour les instructions concernant la préparation et la manipulation du médicament avant administration, voir la rubrique Précautions particulières d'élimination et de manipulation.
Durée de conservation :
Flacon non
ouvert
3 ans.
Après
préparation de la perfusion
La stabilité chimique et physique en cours d'utilisation, depuis le moment de
la préparation, a été démontrée comme suit (les délais incluent la période
d'administration) :
| Préparation de la perfusion |
Stabilité chimique et physique en cours d'utilisation
|
|
|
Conservation entre 2ºC et 8ºC à l'abri de la lumière |
Conservation à température ambiante (≤ 25°C) et à la lumière |
|
|
Non diluée ou diluée dans une
solution injectable de chlorure de sodium à 9 mg/mL (0,9 %) |
30 jours |
24 heures (sur un total de 30 jours de conservation) |
|
Diluée dans une solution
injectable de glucose à 50 mg/mL (5 %) |
7 jours |
8 heures (sur un total de 7 jours de conservation) |
D'un point de vue microbiologique, la solution pour perfusion préparée doit être utilisée immédiatement, indépendamment du diluant. Si elle n'est pas utilisée immédiatement, les durées et les conditions de conservation après dilution et jusqu'à l'utilisation sont sous la responsabilité de l'utilisateur et ne doivent normalement pas dépasser 7 jours entre 2°C et 8°C ou 8 heures (sur un total de 7 jours de conservation) à température ambiante (≤ 25°C). Une manipulation aseptique doit être assurée durant la préparation de la perfusion (voir rubrique Précautions particulières d'élimination et de manipulation).
Précautions particulières de conservation :
A conserver au
réfrigérateur (entre 2°C et 8°C).
Ne pas congeler.
A conserver dans l'emballage extérieur d'origine, à l'abri de la lumière.
Le flacon non ouvert peut être conservé à température ambiante contrôlée
jusqu'à 25°C et à la lumière ambiante jusqu'à 48 heures.
Pour les conditions de conservation après préparation de la perfusion, voir rubrique Durée de conservation.
En l'absence d'études de compatibilité, ce médicament ne doit pas être mélangé avec d'autres médicaments. OPDIVO ne doit pas être perfusé de manière concomitante avec d'autres médicaments, dans la même ligne de perfusion.
Aucun cas de surdosage n'a été rapporté dans les essais cliniques. En cas de surdosage, les patients doivent être étroitement surveillés à la recherche de signes ou symptômes évocateurs d'effets indésirables, et un traitement symptomatique approprié doit être instauré immédiatement.
Classe pharmacothérapeutique : Agents antinéoplasiques, anticorps monoclonaux et conjugués anticorps-médicaments, inhibiteurs PD-1/PDL-1 (Programmedcell deathprotein 1/death ligand 1). Code ATC : L01FF01.
Mécanisme d'action
Nivolumab est un anticorps monoclonal humain (HuMAb) de type immunoglobuline G4 (IgG4), qui se lie au
récepteur PD-1 (programmed death-1) et bloque son
interaction avec PD-L1 et PD-L2. Le récepteur PD-1 est un régulateur négatif de
l'activité des cellules T, et il a été démontré qu'il est impliqué dans le
contrôle de la réponse immunitaire des cellules T. La liaison du PD-1 avec les
ligands PD-L1 et PD-L2, qui sont exprimés sur les cellules présentatrices
d'antigène et peuvent être exprimés par les cellules tumorales ou par d'autres
cellules du micro-environnement tumoral, entraîne une
inhibition de la prolifération des cellules T et de la sécrétion de cytokines. Nivolumab potentialise les réponses des cellules T,
incluant les réponses antitumorales, par un blocage
de la liaison de PD-1 aux ligands PD-L1 et PD-L2. Dans des modèles syngéniques chez la souris, le blocage de l'activité du
PD-1 a entraîné une diminution de la croissance de la tumeur.
L'inhibition médiée par nivolumab (anti-PD-1) associé à l'ipilimumab (anti-CTLA-4) entraîne l'amélioration des réponses anti-tumorales dans le mélanome métastatique. Dans des modèles de tumeurs murines syngéniques, le double blocage de PD-1 et CTLA-4 a entraîné une activité anti-tumorale synergique.
Efficacité et sécurité clinique
Sur la base d'un modèle de relations dose/réponse de l'efficacité et de la tolérance, il n'y a pas de différences cliniquement significatives en termes d'efficacité et de tolérance entre la posologie de nivolumab à 240 mg toutes les 2 semaines et à 3 mg/kg toutes les 2 semaines. De plus, sur la base de ces relations, il n'y a pas eu de différences cliniquement significatives entre la posologie de nivolumab à 480 mg toutes les 4 semaines et à 3 mg/kg toutes les 2 semaines dans le traitement adjuvant du mélanome, le mélanome avancé et le CCR avancé.
Mélanome
Traitement du mélanome avancé
Etude de phase 3 randomisée versus dacarbazine
(CA209066)
La tolérance et l'efficacité de nivolumab 3 mg/kg
dans le traitement du mélanome avancé (non résécable
ou métastatique) ont été évaluées dans une étude de phase 3, randomisée, en
double aveugle (CA209066). L'étude incluait des patients adultes (âgés de 18
ans ou plus) avec un mélanome de Stade III ou IV BRAF non muté confirmé, naïfs
de traitement, et avec un statut de performance ECOG de 0 ou 1. Les patients
avec une maladie auto-immune active, un mélanome oculaire, ou des métastases
cérébrales ou leptoméningées actives ont été exclus
de l'étude.
Un
total de 418 patients a été randomisé pour recevoir soit nivolumab
(n = 210) administré sur 60 minutes par voie intraveineuse, à la dose de 3
mg/kg toutes les 2 semaines, soit dacarbazine (n =
208) à la dose de 1 000 mg/m2 toutes les 3 semaines. La
randomisation était stratifiée selon le statut PD-L1 de la tumeur et le statut
métastatique (M0/M1a/M1b versus M1c). Le traitement était poursuivi tant
qu'un bénéfice clinique était observé ou jusqu'à intolérance au traitement.
Après progression de la maladie, le traitement était autorisé pour les patients
avec un bénéfice clinique et sans événements indésirables substantiels avec le
traitement à l'étude, selon le jugement de l'investigateur. Des évaluations de
la tumeur ont été effectuées selon les critères RECIST (Response
Evaluation Criteria in Solid Tumours),
version 1.1, 9 semaines après la randomisation puis toutes les 6 semaines au
cours de la première année, et toutes les 12 semaines par la suite. Le critère
principal d'évaluation de l'efficacité était la SG. Les principaux critères
secondaires d'évaluation de l'efficacité étaient la SSP et le taux de réponse
objective (Objective Response Rate : ORR) évalués par
l'investigateur.
Les caractéristiques à l'inclusion étaient comparables entre les deux groupes.
L'âge médian était de 65 ans (de 18 à 87 ans), 59 % étaient de sexe masculin et
99,5 % étaient de type caucasien. La plupart des patients avaient un statut de
performance ECOG de 0 (64 %) ou 1 (34 %). Soixante-et-un pourcent des patients
avaient une maladie de stade M1c à l'entrée dans l'étude. Soixante-quatorze
pourcent des patients avaient un mélanome cutané, et 11 % avaient un mélanome
muqueux; 35 % des patients avaient un mélanome PD-L1 positif (≥ 5
% d'expression sur la membrane de la cellule tumorale).
Seize pourcent des patients ont reçu un traitement adjuvant antérieur; le
traitement adjuvant le plus fréquent était l'interféron (9 %). Quatre pourcent
des patients avaient un antécédent de métastase cérébrale, et 37 % avaient un
taux de LDH à l'inclusion plus élevé que la LSN à l'entrée dans l'étude.
Les courbes de Kaplan-Meier pour la SG sont montrées à la Figure 1.
Figure 1 : Courbes de Kaplan-Meier pour la SG (CA209066)
Le bénéfice observé en SG a été démontré de façon constante entre les sous-groupes de patients incluant le statut de performance ECOG à l'inclusion, le stade métastatique, l'historique en termes de métastases cérébrales et le niveau de LDH à l'inclusion. Un bénéfice en survie a été observé indépendamment du statut PD-L1 sur les cellules tumorales (seuils d'expression membranaire tumorale de 5 % ou 10 %).
Les données disponibles indiquent que la survenue de l'effet de nivolumab est retardée de telle manière que le bénéfice de nivolumab sur la chimiothérapie peut prendre 2-3 mois.
Les résultats d'efficacité sont montrés dans le Tableau 9.
Tableau
9 : Résultats d'efficacité (CA209066)
| nivolumab (n = 210) | dacarbazine (n = 208) | |
| Survie globale | ||
| Evénements | 50 (23,8 %) | 96 (46,2 %) |
| Hazard ratio | 0,42 | |
| IC 99,79 % | (0,25 ; 0,73) | |
| IC 95 % | (0,30 ; 0,60) | |
| p-value | < 0,0001 | |
| Médiane (IC 95 %) | Non atteint | 10,8 (9,33 ; 12,09) |
| Taux (IC 95 %) | ||
| A 6 mois | 84,1 (78,3 ; 88,5) | 71,8 (64,9 ; 77,6) |
| A 12 mois | 72,9 (65,5 ; 78,9) | 42,1 (33,0 ; 50,9) |
| Survie sans progression | ||
| Evénements | 108 (51,4 %) | 163 (78,4 %) |
| Hazard ratio | 0,43 | |
| IC 95 % | (0,34 ; 0,56) | |
| p-value | < 0,0001 | |
| Médiane (IC 95 %) | 5,1 (3,48 ; 10,81) | 2,2 (2,10 ; 2,40) |
| Taux (IC 95 %) | ||
| A 6 mois | 48,0 (40,8 ; 54,9) | 18,5 (13,1 ; 24,6) |
| A 12 mois | 41,8 (34,0 ; 49,3) | NA |
| Réponse objective | 84 (40,0 %) | 29 (13,9 %) |
| (IC 95 %) | (33,3 ; 47,0) | (9,5 ; 19,4) |
| Odds ratio (IC 95 %) | 4,06 (2,52 ; 6,54) | |
| p-value | < 0,0001 | |
| Réponse complète (RC) | 16 (7,6 %) | 2 (1,0 %) |
| Réponse partielle (RP) | 68 (32,4 %) | 27 (13,0 %) |
| Maladie stable (MS) | 35 (16,7 %) | 46 (22,1 %) |
| Durée médiane de réponse | ||
| Mois (intervalle) | Non atteint (0+-12,5+) | 6,0 (1,1-10,0+) |
| Délai médian de réponse | ||
| Mois (intervalle) | 2,1 (1,2-7,6) | 2,1 (1,8-3,6) |
“+”
indique une donnée censurée.
Etude de phase 3 randomisée versus chimiothérapie (CA209037)
La tolérance et l'efficacité de nivolumab 3 mg/kg dans le traitement du mélanome avancé (non résécable ou métastatique) ont été évaluées dans le cadre d'une étude de phase 3, randomisée, en ouvert (CA209037). L'étude a inclus des patients adultes ayant progressé sous ou après traitement par ipilimumab et, dans le cas de mutation BRAF V600 positive, ayant également progressé sous ou après traitement par inhibiteur de BRAF. Les patients avec une maladie auto-immune active, un mélanome oculaire, métastases cérébrales ou leptoméningées actives ou avec un antécédent connu d'effets indésirables de grade élevé (Grade 4 selon les critères CTCAE v4.0) liés au traitement par ipilimumab, excepté pour les cas résolus de nausée, fatigue, réactions à la perfusion ou endocrinopathies, ont été exclus de l'étude.
Un total de 405 patients a été randomisé, et a reçu soit du nivolumab (n = 272) administré sur 60 minutes par voie intraveineuse à la dose de 3 mg/kg toutes les 2 semaines, soit une chimiothérapie (n = 133) au choix de l'investigateur, qui consistait soit en l'administration de dacarbazine (1 000 mg/m2 toutes les 3 semaines), soit en l'administration de carboplatine (AUC 6 toutes les 3 semaines) et paclitaxel (175 mg/m2 toutes les 3 semaines). La randomisation a été stratifiée selon le statut BRAF et PD-L1 de la tumeur, et la meilleure réponse au traitement antérieur par ipilimumab.
Le co-critère principal de mesure d'efficacité était le taux de réponse objective confirmée chez les 120 premiers patients traités par nivolumab, mesuré par un comité de revue radiologique indépendant (IRRC) à l'aide des Critères d'Evaluation de la Réponse dans les Tumeurs Solides RECIST, version 1.1, et la comparaison de la SG du nivolumab à celle de la chimiothérapie. Des critères d'évaluation supplémentaires incluaient la durée et le délai de réponse.
L'âge médian était de 60 ans (de 23 à 88 ans). Soixante-quatre pourcent des patients étaient de sexe masculin et 98 % étaient de type caucasien. Les scores de performance ECOG étaient de 0 pour 61 % des patients, et de 1 pour 39 %. La majorité (75 %) des patients avaient une maladie de stade M1c au début de l'étude. Soixante-treize pourcent des patients avaient un mélanome cutané et 10 % avaient un mélanome muqueux. Le nombre de traitement systémique préalable reçu était de 1 pour 27 % des patients, 2 pour 51 % des patients, et > 2 pour 21 % des patients. Vingt-deux pourcent des patients présentaient des tumeurs BRAF positives et 50 % des patients présentaient des tumeurs considérées comme PD-L1 positives. Soixante-quatre pourcent des patients n'avaient pas présenté de bénéfice clinique antérieur (RC/RP ou MS) sous ipilimumab. Les caractéristiques à l'inclusion étaient comparables entre les groupes, à l'exception des proportions de patients avec des antécédents de métastases cérébrales (19 % et 13 % dans les groupes nivolumab et chimiothérapie, respectivement), et de patients avec LDH supérieure à LSN à l'inclusion (51 % et 35 %, respectivement).
Au moment de cette analyse finale portant sur le taux de réponse objective, les résultats de 120 patients traités par nivolumab et de 47 patients traités par chimiothérapie, ayant eu un minimum de 6 mois de suivi, ont été analysés. Les résultats d'efficacité sont présentés dans le Tableau 10.
Tableau
10 : Meilleure réponse globale,
délai et durée de réponse (CA209037)
|
nivolumab
(n = 120) |
chimiothérapie (n = 47) |
|
| Réponse objective confirmée (IRRC) | 38 (31,7 %) | 5 (10,6 %) |
| (IC 95 %) | ( 23,5 ; 40,8) | (3,5 ; 23,1) |
| Réponse complète (RC) | 4 (3,3 %) | 0 |
| Réponse partielle (RP) | 34 (28,3 %) | 5 (10,6 %) |
| Maladie stable (MS) | 28 (23,3 %) | 16 (34,0 %) |
| Durée médiane de réponse | ||
| Mois (intervalle) | Non atteinte | 3,6 (Non disponible) |
| Délai médian de réponse | ||
| Mois (intervalle) | 2,1 (1,6-7,4) | 3,5 (2,1-6,1) |
Les données disponibles indiquent que le début de l'effet de nivolumab est retardé de telle sorte que le bénéfice de nivolumab sur la chimiothérapie peut prendre 2-3 mois.
Analyse actualisée (24 mois de suivi)
Parmi tous les patients randomisés, l'ORR était de 27,2 % (IC à 95 % : 22,0 ;
32,9) dans le groupe nivolumab et de 9,8 % (IC à 95 %
: 5,3 ; 16,1) dans le groupe chimiothérapie. Les durées médianes de réponse
étaient de 31,9 mois (de 1,4+ à 31,9) et de 12,8 mois (de 1,3+
à 13,6+), respectivement. Le HR de la SSP pour le nivolumab par rapport à chimiothérapie était de 1,03 (IC à
95 % : 0,78 ; 1,36). L'ORR et la SSP ont été évalués par l'IRRC à l'aide des
critères RECIST, version 1.1.
Il n'y a pas eu de différence statistiquement significative entre nivolumab et la chimiothérapie lors de l'analyse finale de SG. L'analyse primaire de SG n'a pas été ajustée pour tenir compte des traitements ultérieurs, dont 54 patients (40,6 %) du bras chimiothérapie ayant reçu un traitement par anti-PD1 par la suite. La SG peut être biaisée par le taux de sortie d'étude, le déséquilibre des traitements ultérieurs et les différences dans les facteurs à l'inclusion. Davantage de patients dans le bras nivolumab présentaient des facteurs pronostiques défavorables (taux élevé de LDH et métastases cérébrales) que dans le bras chimiothérapie.
Efficacité selon le statut BRAF : Les réponses objectives au nivolumab (selon la définition du co- critère primaire) ont été observées chez les patients présentant un mélanome avec ou sans mutation BRAF. Les ORR dans le sous-groupe de patients mutés BRAF étaient de 17 % (IC à 95 % : 8,4 ; 29,0) pour le nivolumab et de 11 % (IC à 95 % : 2,4 ; 29,2) pour la chimiothérapie, et dans le sous-groupe de patients BRAF sauvages, ils étaient de 30 % (IC à 95 % : 24,0 ; 36,7) et de 9 % (IC à 95 % : 4,6 ; 16,7), respectivement.
Les HR de la SSP pour le nivolumab par rapport à la chimiothérapie étaient de 1,58 (IC à 95 % : 0,87 ; 2,87) chez les patients mutés BRAF et de 0,82 (IC à 95 % : 0,60 ; 1,12) chez les patients BRAF sauvages. Les HR de SG pour le nivolumab par rapport à la chimiothérapie étaient de 1,32 (IC à 95 % : 0,75 ; 2,32) chez les patients BRAF mutés et de 0,83 (IC à 95 % : 0,62 ; 1,11) chez les patients BRAF sauvages.
Efficacité selon l'expression tumorale de PD-L1 : Les réponses objectives au nivolumab ont été observées indépendamment de l'expression tumorale de PD-L1. Le rôle de ce biomarqueur (expression tumorale de PD-L1) n'a toutefois pas été complètement élucidé.
Chez les patients dont l'expression tumorale de PD-L1 était ≥ 1 %, l'ORR était de 33,5 % pour le nivolumab (n = 179 ; IC à 95 % : 26,7 ; 40,9) et de 13,5 % pour la chimiothérapie (n = 74 ; IC à 95 % : 6,7 ; 23,5). Chez les patients dont l'expression tumorale de PD-L1 était < 1 %, l'ORR selon l'IRRC était de 13,0 % (n = 69 ; IC à 95 % : 6,1 ; 23,3) et de 12,0 % (n = 25 ; IC à 95 % : 2,5 ; 31,2), respectivement.
Les HR de SSP pour le nivolumab par rapport à la chimiothérapie étaient de 0,76 (IC à 95 % : 0,54 ; 1,07) chez les patients dont l'expression tumorale de PD-L1 était ≥ 1 % et de 1,92 (IC à 95 % : 1,05 ; 3,5) chez les patients dont l'expression tumorale de PD-L1 était < 1 %.
Les HR de SG pour le nivolumab par rapport à la chimiothérapie étaient de 0,69 (IC à 95 % : 0,49 ; 0,96) chez les patients dont l'expression tumorale de PD-L1 était ≥ 1 % et de 1,52 (IC à 95 % : 0,89 ; 2,57) chez les patients dont l'expression tumorale de PD-L1 était < 1 %.
Ces analyses de sous-groupes doivent être interprétées avec prudence compte tenu du faible effectif des sous-groupes et de l'absence de différence statistiquement significative en termes de SG dans l'ensemble de la population randomisée.
Etude de phase 1 d'escalade de dose en ouvert (MDX1106-03)
La tolérance et l'efficacité du nivolumab ont été
évaluées dans le cadre d'une étude d'escalade de dose de phase 1, en ouvert,
dans plusieurs types de tumeurs, incluant le mélanome malin. Parmi les 306
patients précédemment traités inclus dans l'étude, 107 avaient un mélanome et
ont reçu du nivolumab à la dose de 0,1 mg/kg, 0,3
mg/kg, 1 mg/kg, 3 mg/kg, ou 10 mg/kg durant 2 ans maximum. Dans cette
population de patients, une réponse objective a été rapportée chez 33 patients
(31 %) avec une durée médiane de réponse de 22,9 mois (IC à 95 %: 17,0; NR). La
SSP médiane était de 3,7 mois (IC à 95 %: 1,9 ; 9,3). La SG médiane était de
17,3 mois (IC à 95 %: 12,5; 37,8), et les taux estimés de SG étaient de 42 %
(IC à 95 % : 32 ; 51) à 3 ans, de 35 % (IC à 95 % : 26 ; 44) à 4 ans, et de 34%
(IC à 95 % : 25 ; 43) à 5 ans (suivi minimum de 45 mois).
Étude de phase 2 à un bras de traitement (CA209172)
L'étude CA209172 était une étude en ouvert à un seul bras de traitement par nivolumab en monothérapie chez des patients atteints d'un
mélanome métastatique de stade III (non résécable) ou
de stade IV après un traitement préalable par un anticorps monoclonal
anti-CTLA-4. La tolérance était le critère d'évaluation principal et
l'efficacité était un critère d'évaluation secondaire. Sur les 1 008 patients
traités, 103 (10 %) avaient un mélanome oculaire/uvéal, 66 (7 %) avaient un
score de performance ECOG de 2, 165 (16 %) avaient des métastases cérébrales
asymptomatiques traitées et non traitées, 13 (1,3 %) avaient des métastases leptoméningées traitées, 25 (2 %) avaient une maladie
auto-immune et 84 (8 %) avaient un effet indésirable d'origine immunologique de
Grade 3 ou 4 avec un traitement antérieur anti-CTLA-4. Aucun nouveau signal de
sécurité n'a été identifié chez tous les patients traités et le profil de
tolérance général du nivolumab était similaire dans
les sous-groupes. Les résultats d'efficacité basés sur les taux de réponse
évalués par l'investigateur à 12 semaines sont présentés dans le Tableau 11
ci-dessous.
Tableau
11 : Taux de réponse à 12 semaines - tous les patients évaluables par
sous-groupe (CA209172)
| Total |
Mélanome oculaire/ uvéal |
Score de performance ECOG de 2 | Métastases cérébrales |
Maladie auto- immune |
EI d'origine immunologique de Grade 3 ou 4 avec anti-CTLA-4 | |
|
N (%)a |
161/588 (27,4) |
4/61 (6,6) |
4/20 (20,0) |
20/73 (27,4) |
3/16 (18,8) |
3/46 (28,3) |
a Les réponses ont été évaluées selon RECIST 1.1 pour
588/1008 (58,3 %) des patients ayant poursuivi le traitement jusqu'à la semaine
12 et ayant eu un scanner de suivi à la semaine 12.
Etude de phase 3 randomisée avec nivolumab
en association à l'ipilimumab ou avec nivolumabenmonothérapie vs ipilimumab en monothérapie (CA209067)
La tolérance et l'efficacité de nivolumab 1 mg/kg en
association à l'ipilimumab 3 mg/kg ou de nivolumab 3 mg/kg vs ipilimumab
3 mg/kg en monothérapie dans le traitement du mélanome avancé (non résécable ou métastatique) ont été évaluées dans une étude
de phase 3, randomisée, en double aveugle (CA209067). Les différences entre les
deux groupes contenant du nivolumab ont été évaluées
de façon descriptive. L'étude a inclus des patients adultes avec un mélanome
non-résécable confirmé de Stade III ou de Stade IV.
Les patients devaient avoir un statut de performance ECOG de 0 ou 1. Les
patients n'ayant pas reçu de traitement anticancéreux systémique antérieur pour
un mélanome non résécable ou métastatique ont été
inclus. Un traitement adjuvant ou néoadjuvant
antérieur était autorisé s'il était terminé au moins 6 semaines avant la
randomisation. Les patients avec une maladie auto-immune active, un mélanome
oculaire/uvéal, ou des métastases cérébrales ou leptoméningées
actives ont été exclus de l'étude.
Un total de 945 patients a été randomisé pour recevoir soit nivolumab en association à l'ipilimumab (n = 314), nivolumab en monothérapie (n = 316), ou ipilimumab en monothérapie (n = 315). Les patients dans le bras d'association ont reçu nivolumab à la dose de 1 mg/kg sur 60 minutes et ipilimumab à la dose de 3 mg/kg sur 90 minutes, administrés par voie intraveineuse toutes les 3 semaines pour les 4 premières doses, suivi de nivolumab à la dose de 3 mg/kg en monothérapie toutes les 2 semaines. Les patients dans le bras de nivolumab en monothérapie ont reçu nivolumab à la dose de 3 mg/kg toutes les 2 semaines. Les patients dans le bras comparateur ont reçu ipilimumab à la dose de 3 mg/kg et le placebo correspondant au nivolumab par voie intraveineuse toutes les 3 semaines pour 4 doses, suivi du placebo toutes les 2 semaines. La randomisation était stratifiée selon l'expression de PD-L1 (≥ 5 % vs < 5 % d'expression sur la membrane de la cellule tumorale), le statut BRAF et le stade métastatique d'après le système des stades de l'AJCC (American Joint Committee on Cancer). Le traitement était poursuivi tant qu'un bénéfice clinique était observé ou jusqu'à ce que le patient ne puisse plus tolérer le traitement. Les évaluations tumorales ont été réalisées 12 semaines après la randomisation puis toutes les 6 semaines au cours de la première année, et toutes les 12 semaines par la suite. Les critères principaux d'évaluation étaient la survie sans progression et la SG. L'ORR et la durée de réponse étaient également évalués.
Les
caractéristiques à l'inclusion étaient comparables entre les trois bras de
traitement. L'âge médian était de 61 ans (de 18 à 90 ans), 65 % des patients
étaient desexe masculin et 97 % étaient de type
caucasien. Le statut de performance ECOG était de 0 (73 %) ou 1 (27 %). La
majorité des patients (93 %) avait une maladie à un Stade IV selon l'AJCC ; 58
% avaient un stade métastatique M1c à l'entrée dans l'étude. Vingt-deux
pourcent des patients avaient reçu un traitement adjuvant antérieur.
Trente-deux pourcent des patients présentaient un mélanome avec une mutation
BRAF positive ; 26,5 % des patients avaient ≥ 5 % d'expression de PD-L1
sur la membrane de la cellule tumorale.
Quatre pourcent de patients présentaient des antécédents de métastases
cérébrales, et 36 % des patients présentaient un niveau de LDH à l'inclusion
plus important que la LSN à l'entrée de l'étude. Parmi les patients avec une
expression tumorale quantifiable de PD-L1, la distribution des patients était
comparable entre les trois groupes de traitement. L'expression tumorale de
PD-L1 était déterminée en utilisant le test PD-L1 IHC 28-8 pharmDx.
Lors de l'analyse primaire (suivi minimum de 9 mois), la médiane de SSP était de 6,9 mois dans le bras nivolumab versus 2,9 mois dans le bras ipilimumab (HR = 0,57 ; IC à 99,5 % : 0,43 ; 0,76 ; p < 0,0001). La médiane de SSP était de 11,5 mois dans le bras nivolumab en association à ipilimumab, versus 2,9 mois dans le bras ipilimumab (HR = 0,42 ; IC à 99,5 % : 0,31 ; 0,57 ; p < 0,0001).
Les résultats de SSP de l'analyse descriptive (avec un suivi minimum de 60 mois) sont présentés dans la Figure 2 (toute la population randomisée), la Figure 3 (au seuil de 5 % d'expression de PD-L1) et la Figure 4 (au seuil de 1 % d'expression de PD-L1).
Figure 2 : Survie sans progression (CA209067)
Figure 3 : Survie sans progression selon l'expression de PD-L1 : seuil de 5 % (CA209067)
Figure 4 : Survie sans progression selon l'expression de PD-L1 : seuil de 1 % (CA209067)
L'analyse
finale (primaire) de la SG a été effectuée lorsque tous les patients avaient un
suivi minimum de 28 mois. À 28 mois, la médiane de SG n'a pas été atteinte dans
le bras nivolumab comparée aux 19,98 mois observés
dans le bras ipilimumab (HR = 0,63 ; IC 98 % : 0,48 ;
0,81 ; p-value : < 0,0001). La médiane de SG n'a pas été atteinte dans
le bras nivolumab en association à ipilimumab comparée au bras ipilimumab
(HR = 0,55 ; IC 98 % : 0,42 ; 0,72 ; p-value : < 0,0001).
Les résultats de SG lors d'une analyse descriptive complémentaire avec un suivi
minimum de 90 mois montrent des résultats cohérents avec l'analyse primaire
initiale. Les résultats de SG de cette analyse de suivi sont présentés dans la
Figure 5 (ensemble de la population randomisée), dans les Figures 6 et 7 (aux
seuils de 5% et 1% d'expression de PD-L1).
L'analyse de la SG n'a pas été ajustée pour tenir compte des traitements reçus
ultérieurement. Dans les bras ayant reçu l'association, nivolumab
en monothérapie et ipilimumab, respectivement, 36,0
%, 49,1 % et 66,3 % des patients ont reçu un traitement systémique ultérieur.
Dans les bras ayant reçu l'association, nivolumab en
monothérapie et ipilimumab, respectivement, 19,1 %,
34,2 % et 48,3 % des patients ont reçu une immunothérapie ultérieure (incluant
un traitement anti PD1, un anticorps anti CTLA 4 ou une autre immunothérapie).
Figure 5 : Survie globale (CA209067) - Suivi minimum de 90 mois
Figure 6 : Survie globale selon l'expression de PD-L1 : seuil de 5 % (CA209067) - suivi minimum de 90 mois
Figure 7 : Survie globale selon l'expression de PD-L1 : seuil de 1 % (CA209067) - suivi minimum de 90 mois
Le suivi minimum pour l'analyse de l'ORR était de 90 mois. Les réponses sont résumées dans le Tableau 12.
| Tableau 12 : Réponse objective (CA209067) | |||
|
nivolumab + ipilimumab (n = 314) |
nivolumab
(n = 316) |
ipilimumab
(n = 315) |
|
| Réponse objective | 183 (58 %) | 142 (45 %) | 60 (19 %) |
| (IC à 95 %) | (52,6 ; 63,8) | (39,4 ; 50,6) | (14,9 ; 23,8) |
| Odds ratio (vs ipilimumab) | 6,35 | 3,54 | |
| (IC à 95 %) | (4,38 ; 9,22) | (2,49 ; 5,16) | |
| Réponse complète (RC) | 71 (23 %) | 59 (19 %) | 19 (6 %) |
| Réponse partielle (RP) | 112 (36%) | 83 (26 %) | 41 (13 %) |
| Maladie stable (MS) | 38 (12 %) | 29 (9 %) | 69 (22 %) |
| Durée de réponse | |||
| Médiane (intervalle), mois |
N.A. (69,1-N.A.) |
90,8 (45,7-N.A.) |
19,3 (8,8-47,4) |
| Proportion ≥ 12 mois en durée | 68 % | 73 % | 44 % |
| Proportion ≥ 24 mois en durée | 58 % | 63 % | 30 % |
| ORR (IC à 95 %) selon l'expression tumorale de PD-L1 | |||
| < 5 % |
56 % (48,7 ; 62,5) n = 210 |
43 % (36 ; 49,8) n = 208 |
18 % (12,8 ; 23,8) n = 202 |
| ≥ 5 % |
72 % (59,9 ; 82,3) n = 68 |
59 % (47,2 ; 69,6) n = 80 |
21 % (12,7 ; 32,3) n = 75 |
| < 1 % |
54 % (44,4 ; 62,7) n = 123 |
36 % (27,2 ; 45,3) n = 117 |
18 % (11,2 ; 26,0) n = 113 |
| ≥ 1 % |
65 % (56,4 ; 72) n = 155 |
55 % (47,2 ; 62,6) n = 171 |
20 % (13,7 ; 26,4) n = 164 |
Les deux bras contenant du nivolumab ont démontré un bénéfice en SSP et en SG significatif et un ORR plus important comparé à ipilimumab seul. Les résultats de SSP observés à 18 mois de suivi et les résultats d'ORR et de SG à 28 mois de suivi ont été systématiquement démontrés entre les sous-groupes de patients, incluant le statut de performance ECOG à l'inclusion, le statut BRAF, le stade métastatique, l'âge, l'historique en termes de métastases cérébrales et le niveau de LDH à l'inclusion. Cette observation a été maintenue pour les résultats de SG avec un suivi minimum de 90 mois.
Parmi les 131 patients ayant arrêté l'association pour cause d'effet indésirable après 28 mois de suivi, l'ORR était de 71 % (93/131) avec 20 % (26/131) atteignant une réponse complète, et la SG médiane n'était pas atteinte.
Les deux bras contenant du nivolumab ont démontré des taux de réponse objective plus importants qu'avec l'ipilimumab, indépendamment des niveaux d'expression de PD-L1. Les ORR étaient plus élevés pour l'association du nivolumab et de l'ipilimumab par rapport au nivolumab en monothérapie pour tous les niveaux d'expression tumorale de PD-L1 (Tableau 12) après 60 mois de suivi, avec une meilleure réponse globale de la réponse complète coïncidant avec un meilleur taux de survie.
Après
90 mois de suivi, les durées médianes de réponse pour les patients avec un
niveau d'expression tumorale de PD L1 ≥ 5 % étaient de 78,19 mois (de
18,07 à N.A.) dans le bras en association, de 77,21 mois (de 26,25 à N.A.) dans
le bras nivolumab en monothérapie et de 31,28 mois
(de 6,08 à N.A.) dans le bras ipilimumab. Pour une
expression tumorale de PD L1< 5 %, les durées médianes de réponses n'étaient
pas atteintes (de 61,93 à N.A.) dans le bras en association, étaient de 90,84
mois (de 50,43 à N.A.) dans le bras nivolumab en
monothérapie et de 19,25 mois (de 5,32 à 47,44) dans le bras ipilimumab en monothérapie.
Aucun seuil pour l'expression de PD-L1 ne peut être établi de manière fiable en
considérant les critères pertinents de réponse tumorale, de SSP et de SG. Les
résultats des analyses exploratoires multivariées ont identifié des
caractéristiques du patient et de la tumeur (statut de performance ECOG, stade
métastatique, LDH à l'inclusion, statut BRAF, statut PD-L1 et sexe)
susceptibles de contribuer au résultat en termes de survie.
Efficacité par statut BRAF :
Après 90 mois de suivi, les patients avec une mutation BRAF[V600] positive et
les patients avec un statut BRAF sauvage ayant reçu du nivolumab
en association à l'ipilimumab présentaient une SSP
médiane de 16,76 mois (IC à 95 % : 8,28 ; 32,0) et 11,7 mois (IC à 95 % : 7,0 ;
19,32), tandis que les patients du bras nivolumab en
monothérapie présentaient une SSP médiane de 5,62 mois (IC à 95 % : 2,79 ;
9,46) et de 8,18 mois (IC à 95 % : 5,13 ; 19,55), respectivement. Les patients
avec une mutation BRAF [V600] positive et les patients avec un statut BRAF
sauvage randomisés dans le bras ipilimumab en
monothérapie avaient une médiane de PFS de 3,09 mois (IC à 95 % : 2,79 ; 5,19)
et de 2,83 mois (IC à 95 % : 2,76 ; 3,06), respectivement.
Après 90 mois de suivi, les patients avec une mutation BRAF[V600] positive et
les patients avec un statut BRAF sauvage ayant reçu du nivolumab
en association à l'ipilimumab présentaient un ORR de
67,0 % (IC à 95 % : 57,0 ; 75,9 ; n = 103) et 54,0 % (IC à 95 % : 47,1 ; 60,9 ;
n = 211), alors que ceux du bras nivolumab en
monothérapie présentaient un ORR de 37,87 % (IC à 95 % : 28,2 ; 48,1 ; n = 98)
et 48,2 % (IC à 95 % : 41,4 ; 55,0 ; n = 218), respectivement. Les patients
avec une mutation BRAF [V600] positive et les patients avec un statut BRAF
sauvage randomisés dans le bras ipilimumab en
monothérapie avaient un ORR de 23,0 % (IC à 95 % : 15,2 ; 32,5 ; n = 100) et de
17,2 % (IC à 95 % : 12,4 ; 22,9 ; n = 215).
Après 90 mois de suivi, chez les patients avec une mutation BRAF [V600]
positive, la médiane de SG n'était pas atteinte dans le bras en association et
de 45,5 mois dans le bras nivolumab en monothérapie.
La médiane de SG pour les patients avec une mutation BRAF [V600] positive dans
le bras ipilimumab en monothérapie était de 24,6
mois. Chez les patients avec un statut BRAF sauvage, la médiane de SG était de
39,06 mois dans le bras en association, de 34,37 mois dans le bras nivolumab en monothérapie et de 18,5 mois dans le bras ipilimumab en monothérapie. Les HR de SG pour le nivolumab en association à l'ipilimumab
vs nivolumab en monothérapie étaient de 0,66 (IC à 95
% : 0,44 ; 0,98) pour les patients avec une mutation BRAF[V600] positive, et de
0,95 (IC à 95 % : 0,74 ; 1,22) pour les patients avec un statut BRAF sauvage.
Etude de phase 2 randomisée avec nivolumab
en association à l'ipilimumab et ipilimumab(CA209069)
L'étude CA209069 était une étude randomisée, de Phase 2, en double-aveugle
comparant l'association de nivolumab et d'ipilimumab avec l'ipilimumab seul
chez 142 patients atteints d'un mélanome avancé (non résécable
ou métastatique) avec des critères d'inclusion similaires à ceux de l'étude
CA209067 et l'analyse principale chez les patients atteints d'un mélanome de
type BRAF sauvage (77 % des patients). L'ORR évalué par l'investigateur était
de 61 % (IC à 95 % : 48,9 ; 72,4) dans le bras en association (n = 72) versus
11 % (IC à 95 % : 3,0 ; 25,4) pour le bras ipilimumab
(n = 37). Les taux estimés de SG à 2 et 3 ans étaient de 68 % (IC à 95 % : 56 ;
78) et 61 % (IC à 95 % : 49 ; 71), respectivement pour l'association (n = 73)
et de 53 % (IC à 95 % : 36 ; 68) et 44 % (IC à 95 % : 28 ; 60), respectivement
pour ipilimumab (n = 37).
Traitement adjuvant du mélanome
Étude de phase 3 randomisée comparant nivolumab versus placebo (CA20976K)
La
sécurité et l'efficacité du nivolumab 480 mg en
monothérapie pour le traitement de patients présentant une résection complète
du mélanome ont été évaluées dans une étude de phase 3, randomisée, en double
aveugle (CA20976K). L'étude a inclus des patients présentant un statut de
performance ECOG de 0 ou 1 et atteints d'un mélanome histologiquement confirmé
de stade IIB ou IIC selon l'American Joint Committee
on Cancer (AJCC), 8e édition, ayant été complètement réséqué chirurgicalement.
Pour être inclus, les patients devaient avoir subi une résection complète de
leur mélanome primitif, avec des marges négatives et une biopsie du ganglion
lymphatique sentinelle négative, dans les 12 semaines précédant la
randomisation. Les patients étaient inclus quel que soit le statut PD-L1 de
leur tumeur. Les patients présentant un mélanome oculaire/uvéal ou muqueux, une
maladie auto-immune active, une affection nécessitant un traitement systémique
par corticoïdes (≥ 10 mg de prednisone ou équivalent par jour) ou
d'autres médicaments immunosuppresseurs, ainsi que les patients ayant déjà reçu
un traitement pour le mélanome (à l'exception de la chirurgie), ont été exclus
de l'étude.
Un total de 790 patients a été randomisé (selon un rapport 2:1) pour recevoir soit du nivolumab (n = 526) administré pendant 30 minutes par voie intraveineuse, à la dose de 480 mg toutes les 4 semaines, soit un placebo (n = 264), pendant 1 an maximum ou jusqu'à récidive de la maladie ou apparition d'une toxicité inacceptable. La randomisation a été stratifiée selon la catégorie T (T3b versus T4a versus T4b) de l'AJCC, 8e édition. Les évaluations tumorales ont été réalisées toutes les 26 semaines pendant les années 1 à 3, puis toutes les 52 semaines pendant les années 3 à 5. Le critère principal d'évaluation de l'efficacité était la survie sans récidive (SSR). La SSR, évaluée par l'investigateur, était définie comme le temps entre la date de randomisation et la date de la première récurrence (locale, régionale ou métastase à distance), d'un nouveau mélanome primitif ou du décès toutes causes confondues, selon ce qui survient en premier. Les critères secondaires d'évaluation incluaient la SG et la survie sans métastases à distance (SSMD).
Les caractéristiques à l'inclusion étaient de manière générale équilibrées entre les deux groupes. L'âge médian était de 62 ans (de 19 à 92), 61 % étaient de sexe masculin et 98 % étaient de type caucasien. Le score du statut de performance ECOG à l'inclusion était de 0 (94 %) ou de 1 (6 %). Soixante pour cent des patients présentaient une maladie de stade IIB et 40 % présentaient une maladie de stade IIC.
Lors d'une analyse intermédiaire primaire prédéfinie (suivi minimum de 7,8 mois), une amélioration statistiquement significative de la SSR a été démontrée avec le nivolumab par rapport au placebo avec un HR de 0,42 (IC à 95 % : 0,30 ; 0,59 ; p < 0,0001). Lors d'une analyse descriptive actualisée de la SSR (suivi minimum de 15,6 mois), le nivolumab a continué de démontrer une amélioration de la SSR avec un HR de 0,53 (IC à 95 % : 0,40 ; 0,71). La SG n'était pas mature. Les résultats des analyses avec un suivi minimum de 15,6 mois sont résumés dans le Tableau 13 et la Figure 8.
Tableau 13 : Résultats d'efficacité (CA20976K)
|
nivolumab
(n = 526) |
placebo (n = 264) |
|
| Survie sans récidive avec un suivi minimum de 15,6 mois | ||
| Survie sans récidive | ||
| Événements | 102 (19,4 %) | 84 (31,8 %) |
| Hazard ratioa | 0,53 | |
| IC à 95 % | (0,40 ; 0,71) | |
| Médiane (IC à 95 %) en mois | NA | 36,14 (24,77 ; NA) |
| Taux (IC à 95 %) à 12 mois | 88,8 (85,6 ; 91,2) | 81,1 (75,7 ; 85,4) |
| Taux (IC à 95 %) à 18 mois | 83,9 (80,3 ; 86,9) | 70,7 (64,5 ; 76,1) |
a Sur la base d'un modèle de Cox à risque proportionnel
stratifié.
b Sur la base des estimations de Kaplan-Meier.
b Sur la base des estimations de Kaplan-Meier.
Le bénéfice de la SSR était cohérent dans les sous-groupes principaux, notamment ceux en fonction du stade de la maladie, de la catégorie T et de l’âge.
Figure 8 : Survie sans récidive (CA20976K)
Les données concernant l’expression tumorale de PD-L1 étaient disponibles pour 302 (38,2 %) des 790 patients randomisés (36,3 % pour le bras recevant du nivolumab et 42,0 % pour le bras recevant le placebo), l’expression de PD-L1 n’étant pas un facteur de stratification pour la randomisation. Les analyses exploratoires de la SSR selon l’expression de PD-L1 ont montré que le HR pour le nivolumab par rapport au placebo était de 0,43 (IC à 95 % : 0,22 ; 0,84) chez les patients (N = 167) présentant une expression de PD-L1 ≥ 1 %, de 0,82 (IC à 95 % : 0,44 ; 1,54) chez les patients (N = 135) présentant une expression de PD-L1 < 1 % et de 0,50 (IC à 95 % : 0,34 ; 0,73) chez les patients (N = 488) présentant une expression de PD-L1 indéterminée/non rapportée/non évaluable.
Étude de phase 3 randomisée comparant nivolumab versus ipilimumab 10 mg/kg (CA209238)
La
tolérance et l'efficacité du nivolumab 3 mg/kg en
monothérapie pour le traitement de patients présentant une résection complète
du mélanome ont été évaluées dans une étude de phase 3,randomisée, en double
aveugle (CA209238). L'étude incluait des patients adultes, avec un statut de
performance ECOG de 0 ou 1, atteints d'un mélanome à un stade IIIb/c ou à un stade IV selon l'American Joint Committee on Cancer (AJCC), 7e édition, confirmé
par histologie et totalement réséqué par intervention chirurgicale. Selon
l'AJCC 8e édition, cela correspond à des patients dont les ganglions
lymphatiques sont atteints ou présentant des métastases. Les patients étaient
inclus quel que soit le statut PD-L1 de leur tumeur. Les patients ayant des
antécédents de maladie auto-immune, et toute maladie nécessitant un traitement
systémique par corticoïdes (≥ 10 mg de prednisone ou équivalent par jour)
ou autre médicament immunosuppresseur, ainsi que les patients ayant déjà été
traités pour un mélanome (à l'exception de patients ayant subi une intervention
chirurgicale, ayant reçu une radiothérapie adjuvante après une résection
neurochirurgicale de lésions du système nerveux central et ayant terminé un
traitement adjuvant par interféron ≥ 6 mois avant la randomisation),
ayant reçu un traitement antérieur par anticorps anti-PD-1, anti-PD-L1,
anti-PD-L2, anti-CD137 ou anti CTLA-4 (notamment l'ipilimumab
ou tout autre anticorps ou médicament ciblant spécifiquement la co-stimulation ou les points de contrôle immunitaires des
lymphocytes T) étaient exclus de l'étude.
Un total de 906 patients a été randomisé pour recevoir soit nivolumab à la posologie de 3 mg/kg (n = 453) toutes les 2 semaines soit ipilimumab à la posologie de 10 mg/kg (n = 453) toutes les 3 semaines pendant 4 doses, puis toutes les 12 semaines à partir de la semaine 24 jusqu’à 1 an. La randomisation était stratifiée selon l’expression tumorale de PD-L1 (≥ 5 % versus < 5 %/indéterminé) et selon le stade de la maladie d’après le système de classification de l’AJCC. Des évaluations de la tumeur ont été réalisées toutes les 12 semaines pendant les deux premières années, puis tous les 6 mois par la suite. Le critère d’évaluation principal était la survie sans récidive (SSR). La SSR, évaluée par l’investigateur, était définie comme le temps entre la date de randomisation et la date de la première récurrence (métastase locale, régionale ou distante), d’un nouveau mélanome primaire ou du décès toutes causes confondues, selon ce qui survient en premier.
Les caractéristiques à l'inclusion étaient généralement équilibrées entre les deux groupes. L'âge médian était de 55 ans (de 18 à 86), 58 % étaient de sexe masculin et 95 % étaient de type caucasien. Le score de référence du statut de performance ECOG était de 0 (90 %) ou de 1 (10 %). La majorité des patients avaient une maladie de stade III selon l'AJCC (81 %) et 19 % avaient une maladie de stade IV. Quarante-huit pourcent des patients présentaient des ganglions lymphatiques macroscopiques et 32 % présentaient une ulcération de la tumeur. Quarante-deux pourcent des patients étaient positifs à la mutation BRAF V600, 45 % présentaient un gène BRAF de type sauvage et 13 % avaient un statut inconnu du gène BRAF. En ce qui concerne l'expression tumorale de PD-L1, 34 % des patients avaient une expression de PD-L1 ≥ 5 % et 62 % avaient une expression de PD-L1 < 5 % comme défini dans le protocole de l'essai clinique. Parmi les patients présentant une expression tumorale de PD-L1 quantifiable, la répartition des patients entre les groupes de traitement était équilibrée. L'expression tumorale de PD-L1 était déterminée en utilisant le test PD-L1 IHC 28-8 pharmDx.
Lors d’une analyse intermédiaire primaire prédéfinie (suivi minimum de 18 mois), une amélioration statistiquement significative de la SSR a été démontrée avec nivolumab par rapport à ipilimumab avec un HR de 0,65 (IC à 97,56 % : 0,51 ; 0,83 ; valeur de p log-rank stratifié < 0,0001). Lors d’une analyse descriptive actualisée de la SSR, avec un suivi minimum de 24 mois, l’amélioration de la SSR était confirmée avec un HR de 0,66 (IC à 95 % : 0,54 ; 0,81 ; p < 0,0001) et la SG n’était pas mature. Les résultats d’efficacité avec un suivi minimum de 36 mois (analyse finale prédéfinie de la SSR) et de 48 mois (analyse finale prédéfinie de la SG) sont présentés dans le Tableau 14 et aux Figures 9 et 10 (toute la population randomisée).
Tableau
14 : Résultats d'efficacité (CA209238)
|
nivolumab
(n = 453) |
ipilimumab 10 mg/kg (n = 453) |
|
|
Analyse finale prédéfinie
Survie sans récidive avec un suivi minimum de 36 mois |
||
| Événements | 188 (41,5 %) | 239 (52,8 %) |
| Risque relatifa | 0,68 | |
| IC à 95 % | (0,56 ; 0,82) | |
| Valeur p | p < 0,0001 | |
| Médiane (IC à 95 %) en mois | NR (38,67 ; NR) | 24,87 (16,62 ; 35,12) |
| Survie sans récidive avec un suivi minimum de 48 mois | ||
| Événements | 212 (46,8 %) | 253 (55,8 %) |
| Risque relatifa | 0,71 | |
| IC à 95 % | (0,60 ; 0,86) | |
| Médiane (IC à 95 %) en mois | 52,37 (42,51 ; NR) | 24,08 (16,56 ; 35,09) |
| Taux (IC à 95 %) à 12 mois | 70,4 (65,9 ; 74,4) | 60,0 (55,2 ; 64,5) |
| Taux (IC à 95 %) à 18 mois | 65,8 (61,2 ; 70,0) | 53,0 (48,1 ; 57,6) |
| Taux (IC à 95 %) à 24 mois | 62,6 (57,9 ; 67,0) | 50,2 (45,3 ; 54,8) |
| Taux (IC à 95 %) à 36 mois | 57,6 (52,8 ; 62,1) | 44,4 (39,6 ; 49,1) |
| Taux (IC à 95 %) à 48 mois | 21,7 (46,8 ; 56,3) | 41,2 (36,4 ; 45,9) |
|
Analyse
finale prédéfinie
Survie globale avec un suivi minimum de 48 mois |
||
| Événements | 100 (22,1 %) | 111 (24,5 %) |
| Risque relatifa | 0,87 | |
| IC à 95 % | (0,66 ; 1,14) | |
| Valeur p | 0,3148 | |
| Médiane (IC à 95 %) en mois | Non atteinte | Non atteinte |
| Taux (IC à 95 %) à 12 mois | 96,2 (93,9 ; 97,6) | 95,3 (92,8 ; 96.9) |
| Taux (IC à 95 %) à 18 mois | 91,9 (88,9 ; 94,1) | 91,8 (88,8 ; 94,0) |
| Taux (IC à 95 %) à 24 mois | 88,0 (84,6 ; 90,7) | 87,8 (84,4 ; 90,6) |
| Taux (IC à 95 %) à 36 mois | 81,7 (77,8 ; 85,1) | 81,6 (77,6 ; 85,0) |
| Taux (IC à 95 %) à 48 mois | 77,9 (73,7 ; 81,5) | 76,6 (72,2 ; 80,3) |
aProvenant d'un modèle de risques proportionnels
stratifié.
Avec un suivi minimum de 36 mois, l’étude a démontré une amélioration statistiquement significative de la SSR chez les patients randomisés dans le bras nivolumab par rapport au bras ipilimumab 10 mg/kg. Le bénéfice de la SSR était démontré de manière constante dans les sous-groupes, notamment en fonction de l’expression tumorale de PD-L1, du statut du gène BRAF et du stade de la maladie. Avec un suivi minimum de 48 mois, présenté en Figure 9, l’étude a continué à démontrer une amélioration de la SSR dans le bras nivolumab par rapport au bras ipilimumab. Le bénéfice de la SSR a été maintenu entre tous les sous-groupes.
Figure 9 : Survie sans récidive (CA209238)
Figure 10 : Survie globale (CA209238)
Avec un suivi minimum de 48 mois, présenté en Figure 10, la médiane de SG n’était atteinte dans aucun des groupes (HR = 0,87, IC à 95,03 % : 0,66 ; 1,14 ; valeur p : 0,3148). Les données de survie globale sont biaisées par les effets des traitements anti-cancéreux actifs ultérieurs. Un traitement ultérieur par voie systémique a été reçu par 33 % et 42 % des patients dans les bras nivolumab et ipilimumab, respectivement. L’immunothérapie ultérieure (incluant un traitement par anti-PD1, par anticorps anti-CTLA-4 ou par une autre immunothérapie) a été administrée à 23 % et 34 % des patients dans les bras nivolumab et ipilimumab, respectivement.
La qualité de vie (QdV) avec le nivolumab est restée stable et proche de la valeur de référence lors du traitement, évaluée par des échelles valides et fiables comme l'European Organization for Research and Treatment of Cancer (EORTC) QLQ-C30, l'indice d'utilité EQ-5D et l'échelle visuelle analogique (EVA).
Cancer bronchique non à petites cellules
Traitement néoadjuvant du CBNPC
Étude randomisée de phase 3, en ouvert avec nivolumab en association à une chimiothérapie à base de
sels de platine vs une chimiothérapie à base de sels de platine (CA209816)
La sécurité et l'efficacité de nivolumab en
association à une chimiothérapie à base de sels de platine pendant 3 cycles ont
été évaluées dans une étude de phase 3, randomisée, en ouvert (CA209816).
L'étude a inclus des patients présentant un statut de performance ECOG de 0 ou 1, une maladie mesurable (selon les critères RECIST version 1.1) et dont les tumeurs correspondaient à un CBNPC résécable, histologiquement confirmé, de stade IB (≥ 4 cm), II ou IIIA (selon les critères de stadification de la 7e édition de l'AJCC/Union internationale contre le cancer (UICC)).
Les critères de sélection suivants définissent les patients à haut risque de récidive qui sont inclus dans l'indication thérapeutique et qui représentent une population de patients atteints d'une maladie de Stade II à IIIA, selon les critères de stadification de la 7e édition de l'AJCC/UICC : tout patient présentant une taille de tumeur ≥ 5 cm ; tout patient atteint d'une maladie de stade N1 ou N2 (indépendamment de la taille de la tumeur primitive) ; les patients présentant de multiples nodules tumoraux dans le même lobe ou dans d'autres lobes ipsilatéraux ; les patients atteints de tumeurs envahissant les structures thoraciques (envahissant directement la plèvre viscérale, la plèvre pariétale, la paroi thoracique, le diaphragme, le nerf phrénique, la plèvre médiastinale, le péricarde pariétal, le médiastin, le cœur, les gros vaisseaux, la trachée, le nerf laryngé récurrent, l'œsophage, le corps vertébral, la carène) ; ou de tumeurs affectant la bronche souche ; ou de tumeurs associées à une atélectasie ou une pneumopathie inflammatoire obstructive qui se propage à la région hilaire ou affecte l'intégralité du poumon.
L'étude n'a pas inclus de patients présentant une tumeur de stade N2 envahissant également le médiastin, le cœur, les gros vaisseaux, la trachée, le nerf laryngé récurrent, l'œsophage, le corps vertébral, la carène, ou avec un ou plusieurs nodules tumoraux distincts dans un lobe ipsilatéral différent.
Les patients atteints de CBNPC non résécable ou métastatique, présentant des mutations connues de l'EGFR ou des translocations connues ALK (les tests pour les mutations de l'EGFR ou les translocations ALK n'étaient pas obligatoires à l'entrée dans l'étude), d'une neuropathie périphérique de Grade 2 ou supérieur, d'une maladie auto-immune active ou des conditions médicales nécessitant une immunosuppression systémique ont été exclus de l'étude. La randomisation était stratifiée selon le niveau d'expression tumorale de PD-L1 (≥ 1 % vs < 1 % ou non quantifiable), le stade de la maladie (IB/II vs IIIA), et le sexe (masculin vs féminin). Les patients ont été inclus quel que soit le statut PD-L1 de leur tumeur. L'expression tumorale de PD-L1 était déterminée en utilisant le test PD-L1 IHC 28-8 pharmDx.
Un total de 358 patients a été randomisé pour recevoir nivolumab en association à une chimiothérapie à base de sels de platine (n = 179) ou une chimiothérapie à base de sels de platine (n = 179). Les patients du bras nivolumab en association à une chimiothérapie à base de sels de platine ont reçu 360 mg de nivolumab administrés par voie intraveineuse en 30 minutes en association à une chimiothérapie à base de sels de platine toutes les 3 semaines pendant un maximum de 3 cycles. Les patients du bras chimiothérapie ont reçu une chimiothérapie à base de sels de platine administrée toutes les 3 semaines pendant un maximum de 3 cycles. La chimiothérapie à base de sels de platine comprenait, selon le choix de l'investigateur : paclitaxel 175 mg/m2 ou 200 mg/m2 et carboplatine (ASC de 5 ou 6, toutes histologies) ; pémétrexed 500 mg/m2 et cisplatine 75 mg/m2 (histologie non épidermoïde) ; ou gemcitabine 1 000 mg/m2 ou 1 250 mg/m2 et cisplatine 75 mg/m2 (histologie épidermoïde). Dans le bras chimiothérapie, deux options supplémentaires de schéma thérapeutique comprenaient : vinorelbine 25 mg/m2 ou 30 mg/m2 et cisplatine 75 mg/m2 ; ou docétaxel 60 mg/m2 ou 75 mg/m2 et cisplatine 75 mg/m2 (toutes histologies).
Les évaluations tumorales ont été réalisées à l'inclusion, dans les 14 jours suivant la chirurgie, toutes les 12 semaines après la chirurgie pendant 2 ans, puis tous les 6 mois pendant 3 ans, et une fois par an pendant 5 ans jusqu'à la récidive ou la progression de la maladie. Les critères principaux d'efficacité étaient la survie sans événement (SSE) selon l'évaluation de la revue indépendante centralisée en aveugle (Blinded Independent Central Review BICR) et le taux de réponse complète pathologique (RCp) selon une revue anatomopathologique indépendante en aveugle (Blinded Independent PathologyReview, BIPR). La SG était le principal critère secondaire d'efficacité et les critères d'évaluation exploratoires comprenaient la faisabilité de la chirurgie.
Les caractéristiques à l'inclusion chez la population en ITT étaient généralement équilibrées entre les groupes de traitement. L'âge médian était de 65 ans (de 34 à 84 ans) avec 51 % des patients âgés de ≥ 65 ans et 7 % des patients âgés de ≥ 75 ans ; 50 % des patients étaient d'origine asiatique, 47 % étaient de type caucasien et 71 % étaient de sexe masculin. Le statut de performance ECOG à l'inclusion était de 0 (67 %) ou de 1 (33 %) ; 50 % des patients présentaient un statut PD-L1 ≥ 1 % et 43 % des patients présentaient un statut PD-L1 < 1 % ; 5 % présentaient une maladie de stade IB, 17 % de stade IIA, 13 % de stade IIB et 64 % de stade IIIA ; 51 % présentaient une histologie épidermoïde et 49 % une histologie non épidermoïde ; et 89 % étaient d'anciens ou d'actuels fumeurs. La chirurgie définitive a été réalisée chez 83 % des patients du bras nivolumab en association à une chimiothérapie à base de sels de platine et chez 75 % des patients dans le bras chimiothérapie. Le traitement adjuvant systémique a été reçu par 14,8 % des patients du bras nivolumab en association à une chimiothérapie à base de sels de platine et par 25 % des patients dans le bras chimiothérapie.
Lors de l'analyse finale de la RCp et de l'analyse intermédiaire pré-définie de la SSE (suivi minimum de 21 mois) réalisées chez tous les patients randomisés, une amélioration statistiquement significative de la RCp et de la SSE a été démontrée pour les patients randomisés du bras nivolumab en association à une chimiothérapie à base de sels de platine comparé à la chimiothérapie seule. Le taux de réponse RCp était de 24 % dans le bras nivolumab en association à une chimiothérapie et de 2,2 % dans le bras chimiothérapie (différence de la RCp : 21,6 ; IC à 99 % : 13,0 à 30,3 ; odds ratio de la RCp : 13,9 ; IC à 99 % : 3,49 à 55,75 ; p-value stratifiée < 0,0001). La SSE médiane était de 31,6 mois dans le bras nivolumab en association à une chimiothérapie et de 20,8 mois dans le bras chimiothérapie (HR = 0,63 ; IC à 97,38 % : 0,43 à 0,91 ; valeur de p log-rank stratifié de 0,0052). Le HR pour la SG était de 0,57 (IC à 99,67 % : 0,30 ; 1,07) pour le nivolumab en association à une chimiothérapie par rapport à une chimiothérapie seule.
Analyse
exploratoire des sous-groupes selon l'expression tumorale de PD-L1 et le stade
de la maladie
Les principaux résultats d'efficacité pour le sous-groupe de
patients présentant une expression tumorale de PD-L1 ≥ 1 % et une maladie
de stade II-IIIA à partir d'une analyse exploratoire ayant un suivi minimum de
32,9 mois sont présentés dans le Tableau 15.
Tableau 15 : Résultats d'efficacité
chez les patients présentant une expression tumorale PD-L1 ≥ 1 % et une
maladie de stade II-IIIA* (CA209816)
|
nivolumab + chimiothérapie (n = 81) |
chimiothérapie
(n = 86) |
|
| Survie sans événement selon le BICR | ||
| Événements | 22 (27,2 %) | 39 (45,3 %) |
| Hazard ratioa | 0,49 | |
| (IC à 95 %)a | (0,29 ; 0,83) | |
| Médiane (mois)b | NR | 26,71 |
| (IC à 95 %) | (44,42 ; NR) | (13,40 ; NR) |
| Réponse pathologique complète selon le BIPR | ||
| Réponses | 26 (32,1 %) | 2 (2,3 %) |
| IC à 95 %c | (22,2 ; 43,4) | (0,3 ; 8,1) |
| Différence de RCp (IC à 95 %)e | 29,8 % (19,0 ; 40,7) | |
a Sur la base d'un modèle à risques proportionnels de Cox non
stratifié.
b Estimation de Kaplan-Meier.
c Sur la base de la méthode de Clopper et Pearson.
d L'intervalle de confiance bilatéral à 95 % pour la différence non pondérée a été calculé à l'aide de la méthode de Newcombe.
* Critères de stadification de la 7e édition de l'AJCC/UICC.
Le suivi minimum pour la SSE était de 32,9 mois, gel des données du 6 septembre 2022 RCp, gel des données : 28 juillet 2020
b Estimation de Kaplan-Meier.
c Sur la base de la méthode de Clopper et Pearson.
d L'intervalle de confiance bilatéral à 95 % pour la différence non pondérée a été calculé à l'aide de la méthode de Newcombe.
* Critères de stadification de la 7e édition de l'AJCC/UICC.
Le suivi minimum pour la SSE était de 32,9 mois, gel des données du 6 septembre 2022 RCp, gel des données : 28 juillet 2020
Les courbes de Kaplan-Meier pour la SSE pour le sous-groupe de patients présentant une expression tumorale de PD-L1 ≥ 1 % et une maladie de stade II-IIIA, avec un suivi minimum de 32,9 mois, sont présentées dans la Figure 11.
Figure 11 : Courbes de Kaplan-Meier pour la SSE chez les patients présentant une expression tumorale de PD-L1 ≥ 1 % et une maladie de stade II-IIIA (CA209816)
Au moment de l'analyse actualisée de la SSE, une analyse intermédiaire de la SG a été réalisée (suivi minimum de 32,9 mois). Le HR descriptif et exploratoire pour la SG chez les patients présentant une expression tumorale de PD-L1 ≥ 1 % et une maladie de stade II-IIIA était de 0,43 (IC à 95 % : 0,22 ; 0,83) pour le nivolumab en association à une chimiothérapie par rapport à une chimiothérapie seule. Les courbes de Kaplan-Meier pour la SG pour le sous-groupe de patients présentant une expression tumorale de PD-L1 ≥ 1 % et une maladie de stade II-IIIA, avec un suivi minimum de 32,9 mois, sont présentées dans la Figure 12.
Figure 12 : Courbes de Kaplan-Meier pour la SG chez les patients présentant une expression tumorale de PD-L1 ≥ 1 % et une maladie de stade II-IIIA (CA209816)
Traitement de première ligne du CBNPC
Étude randomisée de phase 3 comparant nivolumab
en association à l'ipilimumab et à 2 cycles de
chimiothérapie à base de sels de platine versus 4 cycles de chimiothérapie à
base de sels de platine (CA2099LA)
La tolérance et l'efficacité de nivolumab 360 mg toutes les 3 semaines en association à l'ipilimumab 1 mg/kg toutes les 6 semaines et à 2 cycles de
chimiothérapie à base de sels de platine ont été évaluées dans une étude,
randomisée de phase 3, en ouvert (CA2099LA). L'étude a inclus des patients
(âgés de 18 ans et plus) atteints d'un CBNPC non épidermoïde ou épidermoïde
histologiquement confirmé, de stade IV ou récurrent (selon la 7e
classification de l'International Association for the Study
of Lung Cancer (IASLC)), présentant un statut de performance ECOG de 0 ou 1, et
n'ayant reçu aucun traitement anticancéreux antérieur (y compris, inhibiteurs
de l'EGFR et d'ALK). Les patients ont été inclus indépendamment du statut PD-L1
de leur tumeur.
Les patients présentant des mutations sensibilisantes de l'EGFR ou des translocations ALK, des métastases cérébrales actives (non traitées), une méningite carcinomateuse, une maladie auto-immune active ou des conditions médicales nécessitant une immunosuppression systémique ont été exclus de l'étude. Les patients présentant des métastases cérébrales traitées étaient éligibles si leur état neurologique était revenu à l'état initial 2 semaines au moins avant l'inclusion, et que soit ils ne recevaient plus de corticoïdes soit ils étaient en phase de stabilisation ou de décroissance de la corticothérapie à une dose de < 10 mg de prednisolone par jour ou équivalent. La randomisation a été stratifiée en fonction de l'histologie (épidermoïde ou non épidermoïde), du taux d'expression de PDL1 de la tumeur (≥ 1 % versus < 1 %) et du sexe (masculin versus féminin).
Un
total de 719 patients a été randomisé pour recevoir nivolumab
en association à l'ipilimumab et à une chimiothérapie
à base de sels de platine (n = 361) ou une chimiothérapie à base de sels de
platine (n = 358). Les patients du bras nivolumab en
association à l'ipilimumab et à une chimiothérapie à
base de sels de platine ont reçu nivolumab 360 mg,
administré par voie intraveineuse en 30 minutes toutes les 3 semaines en
association à l'ipilimumab 1 mg/kg, administré par
voie intraveineuse en 30 minutes toutes les 6 semaines et à une chimiothérapie
à base de sels de platine administrée toutes les 3 semaines pour 2 cycles. Les
patients du bras chimiothérapie ont reçu une chimiothérapie à base de sels de
platine administrée toutes les 3 semaines pour 4 cycles ; les patients atteints
de CBNPC non épidermoïde pouvaient recevoir, de façon optionnelle, un
traitement de maintenance par pémétrexed. La
chimiothérapie à base de sels de platine comprenait : carboplatine
(ASC de 5 ou 6) et pémétrexed 500 mg/m², ou cisplatine 75 mg/m² et pémétrexed
500 mg/m² dans le CBNPC non épidermoïde, ou carboplatine
(ASC de 6) et paclitaxel 200 mg/m² dans le CBNPC
épidermoïde.
Le traitement a été poursuivi jusqu'à progression de la maladie, toxicité
inacceptable ou jusqu'à 24 mois. Le traitement pouvait se poursuivre après
progression de la maladie si le patient était cliniquement stable et que l'investigateur
considérait qu'il en tirait un bénéfice clinique. Les patients qui ont arrêté
le traitement en association en raison d'un événement indésirable attribué à l'ipilimumab ont été autorisés à poursuivre le nivolumab en monothérapie. Les évaluations tumorales ont
été réalisées toutes les 6 semaines après la première dose du traitement à
l'étude pendant les 12 premiers mois, puis toutes les 12 semaines et ce jusqu'à
progression de la maladie ou arrêt du traitement à l'étude.
Les
caractéristiques des patients à l'inclusion dans l'étude CA2099LA étaient
généralement équilibrées entre les différents bras de traitement. L'âge médian
était de 65 ans (de 26 à 86 ans), dont 51 % ≥ 65 ans et 10 % ≥ 75
ans. La majorité des patients étaient de type caucasien (89 %) et de sexe
masculin (70 %). Le statut de performance ECOG à l'inclusion était de 0 (31 %)
ou de 1 (68 %), 57 % des patients présentaient un statut PD-L1 ≥ 1 %
et 37 % des patients présentaient un statut PD-L1 < 1 %, 31 % présentaient
une histologie épidermoïde et 69 % présentaient une histologie non épidermoïde,
17 % présentaient des métastases cérébrales et 86 % étaient d'anciens ou
d'actuels fumeurs. Aucun patient n'avait reçu d'immunothérapie antérieure.
Le critère d'évaluation principal de l'efficacité de l'étude CA2099LA était la
SG. Les critères additionnels d'évaluation de l'efficacité étaient la SSP,
l'ORR et la durée de la réponse évalués par une revue centralisée indépendante
en aveugle (BICR).
L'étude a démontré un bénéfice statistiquement significatif pour la SG, la SSP
et l'ORR chez les patients randomisés dans le bras nivolumab
en association à l'ipilimumab et à une chimiothérapie
à base de sels de platine par rapport au bras chimiothérapie à base de sels de
platine seule lors de l'analyse intermédiaire prédéfinie, lorsque 351
événements ont été observés (87 % du nombre d'événements prévus pour l'analyse
finale). Le suivi minimal pour la SG était de 8,1 mois.
Les résultats d'efficacité sont présentés dans la Figure 13 (analyse de la SG mise à jour avec un suivi minimal de 12,7 mois) et dans le Tableau 16 (analyse principale avec un suivi minimal de 8,1 mois). Une analyse actualisée de l'efficacité a été réalisée quand tous les patients avaient atteint un suivi minimum de 12,7 mois (voir Figure 13). Au moment de l'analyse, le hazard ratio pour la SG était de 0,66 (IC à 95 % : 0,55, 0,80) et le hazard ratio pour la SSP était de 0,68 (IC à 95 % : 0,57, 0,82).
Figure 13 : Courbe de Kaplan-Meier de la SG (CA2099LA)
|
nivolumab + ipilimumab + chimiothérapie
(n = 361) |
chimiothérapie
(n = 358) |
|
| Survie globale | ||
| Événements | 156 (43,2 %) | 195 (54,5 %) |
| Hazard ratio | 0,69 | |
| (IC à 96,71 %)a | (0,55 ; 0,87) | |
| Valeur de p log-rank stratifiéb | 0,0006 | |
| Médiane (mois) | 14,1 | 10,7 |
| (IC à 95 %) | (13,24 ; 16,16) | (9,46 ; 12,45) |
| Taux (IC à 95 %) à 6 mois | 80,9 (76,4 ; 84,6) | 72,3 (67,4 ; 76,7) |
| Survie sans progression | ||
| Événements | 232 (64,3 %) | 249 (69,6 %) |
| Hazard ratio | 0,70 | |
| (IC à 97,48 %)a | (0,57 ; 086) | |
| Valeur de p log-rank stratifiéc | 0,0001 | |
| Médiane (mois)d | 6,83 | 4,96 |
| (IC à 95 %) | (5,55 ; 7,66) | (4,27 ; 5,55) |
| Taux (IC à 95 %) à 6 mois | 51,7 (46,2 ; 56,8) | 35,9 (30,5 ; 41,3) |
| Taux de réponse globale | 136 (37,7 %) | 90 (25,1 %) |
| (IC à 95 %) | (32,7 ; 42,9) | (20,7 ; 30,0) |
| Valeur de p test CMH stratifiéf | 0,0003 | |
| Réponse complète (RC) | 7 (1,9 %) | 3 (0,8 %) |
| Réponse partielle (RP) | 129 (35,7 %) | 87 (24,3 %) |
| Durée de la réponse | ||
| Médiane (mois) | 10,02 | 5,09 |
| (IC à 95 %)d | (8,21 ; 13,01) | (4,34 ; 7,00) |
| % avec durée ≥ 6 moisg | 74 | 41 |
a Sur la base du modèle de risque proportionnel de Cox
stratifié.
b La valeur p est comparée à l'alpha attribué de 0,0329 pour cette analyse intermédiaire.
c La valeur p est comparée à l'alpha attribué de 0,0252 pour cette analyse intermédiaire.
d Estimation de Kaplan-Meier.
e Proportion avec réponse complète ou partielle; IC basé sur la méthode de Clopper et Pearson.
f La valeur p est comparée à l'alpha attribué de 0,025 pour cette analyse intermédiaire.
g Sur la base des estimation de Kaplan-Meier de la durée de la réponse.
CMH = Cochran-Mantel-Haenszel
b La valeur p est comparée à l'alpha attribué de 0,0329 pour cette analyse intermédiaire.
c La valeur p est comparée à l'alpha attribué de 0,0252 pour cette analyse intermédiaire.
d Estimation de Kaplan-Meier.
e Proportion avec réponse complète ou partielle; IC basé sur la méthode de Clopper et Pearson.
f La valeur p est comparée à l'alpha attribué de 0,025 pour cette analyse intermédiaire.
g Sur la base des estimation de Kaplan-Meier de la durée de la réponse.
CMH = Cochran-Mantel-Haenszel
Un traitement systémique subséquent a été administré à 28,8 % et 41,1 % des patients du bras d'association et du bras chimiothérapie, respectivement. Une immunothérapie subséquente (notamment anti-PD-1, anti-PD-L1 et anti-CTLA4) a été administrée à 3,9 % et 27,9 % des patients du bras d'association et du bras chimiothérapie, respectivement.
Dans
l'analyse descriptive en sous-groupes relative à la chimiothérapie de l'étude
CA2099LA, un bénéfice en SG a été démontré chez les patients traités par nivolumab en association à l'ipilimumab
et à une chimiothérapie avec histologie épidermoïde (HR [IC à 95 %] 0,65 [0,46
; 0,93], n = 227) et chez les patients avec histologie non épidermoïde (HR [IC
à 95 %] 0,72 [0,55 ; 0,93], n = 492).
Le Tableau 17 résume les résultats d'efficacité de SG, de SSP et d'ORR selon
l'expression tumorale de PD-L1 dans les analyses en sous-groupe pré-spécifiées
au protocole.
Tableau 17 : Résultats d'efficacité selon l'expression tumorale de PD-L1 (CA2099LA)
|
nivolumab
+ ipilimumab + chimiothérapie |
chimiothérapie |
nivolumab
+ ipilimumab + chimiothérapie |
chimiothérapie |
nivolumab
+ ipilimumab + chimiothérapie |
chimiothérapie |
nivolumab
+ ipilimumab + chimiothérapie |
chimiothérapie | |
|
PD-L1
< 1 % (n = 264) |
PD-L1
≥ 1 % (n = 406) |
PD-L1
≥ 1 % à 49 % (n = 233) |
PD-L1
≥ 50 % (n = 173) |
|||||
|
Hazard
ratio de SG (IC à 95 %)a |
0,65 (0,46 ; 0,92) |
0,67 (0,51 ; 0,89) |
0,69 (0,48 ; 0,98) |
0,64 (0,41 ; 1,02) |
||||
|
Hazard
ratio de SSP (IC à 95 %)a |
0,77 (0,57 ; 1,03) |
0,67 (0,53 ; 0,85) |
0,71 (0,52 ; 0,97) |
0,59 (0,40 ; 0,86) |
||||
| ORR % | 31,1 | 20,9 | 41,9 | 27,6 | 37,8 | 24,5 | 48,7 | 30,9 |
a Hazard ratio basé sur un modèle de Cox proportionnel non
stratifié.
Un total de 70 patients atteints d'un CBNPC âgés de ≥ 75 ans a été inclus
dans l'étude CA2099LA (37 patients dans le bras nivolumab
en association à l'ipilimumab et à une chimiothérapie
et 33 patients dans le bras chimiothérapie). Un HR de 1,36 en SG (IC à 95 % :
0,74, 2,52) et un HR de 1,12 en SPP (IC à 95 % : 0,64, 1,96) ont été observés
pour nivolumab en association à l'ipilimumab
et à une chimiothérapie versus chimiothérapie dans ce sous-groupe de patients.
L'ORR était de 27,0 % dans le bras nivolumab en
association à l'ipilimumab et à une chimiothérapie et
de 15,2 % dans le bras chimiothérapie. Quarante-trois pourcent des patients
âgés de ≥ 75 ans ont arrêté le traitement par nivolumab
en association à l'ipilimumab et à une
chimiothérapie. Les données d'efficacité et de tolérance du nivolumab
en association à l'ipilimumab et à une chimiothérapie
étaient limitées pour cette population de patients.
Dans une analyse de sous-groupe, un bénéfice en survie moindre a été observé pour nivolumab en association à l'ipilimumab et à une chimiothérapie par rapport à la chimiothérapie pour les patients qui n'ont jamais fumé. Toutefois, en raison du faible nombre de patients, aucune conclusion définitive ne peut être tirée de ces données.
Traitement du CBNPC après une chimiothérapie antérieure
CBNPC
de type épidermoïde
Etude de phase 3 randomisée versus docétaxel
(CA209017)
La tolérance et l'efficacité de nivolumab 3 mg/kg en
monothérapie dans le traitement du CBNPC de type épidermoïde localement avancé
ou métastatique ont été évaluées dans une étude de phase 3, randomisée, en
ouvert (CA209017). L'étude a inclus des patients (âgés de 18 ans ou plus) dont
la maladie avait progressé pendant ou après une première ligne de
chimiothérapie à base de sels de platine et avec un statut de performance ECOG
de 0 ou 1. Les patients ont été inclus indépendamment du statut PD-L1 de leur
tumeur. Les patients présentant une maladie auto-immune active, une
pneumopathie interstitielle diffuse symptomatique ou des métastases cérébrales
actives ont été exclus de l'étude. Les patients présentant des métastases
cérébrales traitées étaient éligibles si 2 semaines au moins avant l'inclusion
leur état neurologique était revenu à l'état initial, et que soit ils ne
recevaient plus de corticoïdes ou soit ils étaient en phase de stabilisation ou
de décroissance de la corticothérapie (< 10 mg par jour de prednisone ou
équivalents).
Un total de 272 patients a été randomisé pour recevoir soit nivolumab à la posologie de 3 mg/kg (n = 135) administré sur 60 minutes par voie intraveineuse, toutes les 2 semaines, soit docétaxel (n = 137) à la posologie de 75 mg/m2 toutes les 3 semaines. Le traitement était poursuivi tant qu'un bénéfice clinique était observé ou jusqu'à ce que le patient ne puisse plus tolérer le traitement. Les évaluations tumorales ont été réalisées selon les critères RECIST, version 1.1, 9 semaines après la randomisation puis toutes les 6 semaines. Le critère principal était la SG. Les principaux critères secondaires de l'efficacité étaient l'ORR et la SSP évalués par les investigateurs. L'amélioration des symptômes et de l'état de santé général ont été évalués en utilisant le score LCSS (Lung cancer symptom score), l'indice moyen de pénibilité des symptômes et l'échelle visuelle analogique EQ-5D (EQ-VAS), respectivement.
Les caractéristiques à l'inclusion étaient généralement équilibrées entre les deux bras. L'âge moyen était de 63 ans (de 39 à 85 ans), dont 44 % ≥ 65 ans et 11 % ≥ 75 ans. La majorité des patients était de type caucasien (93 %) et de sexe masculin (76 %). Trente-et-un pourcent avaient pour meilleure réponse au traitement antérieur le plus récent une progression de la maladie, et 45 % ont reçu nivolumab dans les 3 mois suivant la fin de leur traitement antérieur le plus récent. Le statut de performance ECOG était de 0 (24 %) ou 1 (76 %).
Les courbes de Kaplan-Meier pour la SG sont présentées dans la Figure 14.
Figure 14 : Courbes de Kaplan-Meier pour la SG (CA209017)
Le bénéfice observé en SG a été démontré de façon constante entre les sous-groupes de patients. Un bénéfice en survie a été observé indépendamment du statut PD-L1 positif ou négatif de la tumeur (seuils d'expression membranaire tumorale de 1 %, 5 % ou 10 %). Cependant, le rôle de ce biomarqueur (expression tumorale de PD-L1) n'a pas été complètement élucidé. Avec un suivi minimum de - 62,6 mois, le bénéfice en SG demeure toujours démontré entre les sous-groupes.
L'étude CA209017 incluait un nombre limité de patients âgés de ≥ 75 ans (11 dans le groupe nivolumab et 18 dans le groupe docétaxel). Nivolumab a montré moins d'effet en valeur numérique sur SG (HR 1,85 ; IC 95 % : 0,76 ; 4,51), SSP (HR = 1,76 ; IC 95 % : 0,77 ; 4,05) et ORR (9,1 % vs 16,7 %). En raison de la petite taille de l'échantillon, aucune conclusion définitive ne peut être tirée de ces données.
Les résultats d'efficacité sont présentés dans le Tableau 18.
Tableau 18 : Résultats d'efficacité (CA209017)
|
nivolumab
(n = 135) |
docétaxel
(n = 137) |
|
|
Analyse principale
Suivi minimum : 10,6 mois |
||
| Survie globale | ||
| Evénements | 86 (63,7 %) | 113 (82,5 %) |
| Hazard ratio | 0,59 | |
| IC à 96,85 % | (0,43 ; 0,81) | |
| p-value | 0,0002 | |
| Médiane (IC à 95 %) mois | 9,23 (7,33 ; 13,27) | 6,01 (5,13 ; 7,33) |
| Taux (IC à 95 %) à 12 mois | 42,1 (33,7 ; 50,3) | 23,7 (16,9 ; 31,1) |
| Réponse objective confirmée | 27 (20,0 %) | 12 (8,8 %) |
| (IC à 95 %) | (13,6 ; 27,7) | (4,6 ; 14,8) |
| Odds ratio (IC à 95 %) | 2,64 (1,27 ; 5,49) | |
| p-value | 0,0083 | |
| Réponse complète (RC) | 1 (0,7 %) | 0 |
| Réponse partielle (RP) | 26 (19,3 %) | 12 (8,8 %) |
| Maladie stable (MS) | 39 (28,9 %) | 47 (34,3 %) |
| Durée médiane de réponse | ||
| Mois (intervalle) | Non atteint (2,9-20,5+) | 8,4 (1,4+-15,2+) |
| Délai médian de réponse | ||
| Mois (intervalle) | 2,2 (1,6-11,8) | 2,1 (1,8-9,5) |
| Survie sans progression | ||
| Evénements | 105 (77,8 %) | 122 (89,1 %) |
| Hazard ratio | 0,62 | |
| IC à 95 % | (0,47 ; 0,81) | |
| p-value | < 0,0004 | |
| Médiane (IC à 95 %) (mois) | 3,48 (2,14 ; 4,86) | 2,83 (2,10 ; 3,52) |
| Taux (IC à 95 %) à 12 mois | 20,8 (14,0 ; 28,4) | 6,4 (2,9 ; 11,8) |
|
Analyse actualisée
Suivi minimum : 24,2 mois |
||
| Survie globale a | ||
| Evénements | 110 (81,4 %) | 128 (93,4 %) |
| Hazard ratio | 0,62 | |
| IC à 95 % | (0,47 ; 0,80) | |
| Taux (IC à 95 %) à 24 mois | 22,9 (16,2 ; 30,3) | 8 (4,3 ; 13,3) |
| Réponse objective confirmée | 20,0 % | 8,8 % |
| (IC à 95 %) | (13,6 ; 27,7) | (4,6 ; 14,8) |
| Durée médiane de réponse | ||
| Mois (intervalle) | 25,2 (2,9-30,4) | 8,4 (1.4+- 18,0+) |
| Survie sans progression Taux (IC à 95 %) à 24 mois | 15,6 (9,7 ; 22,7) | Tous les patients avaient soit progressé, soit étaient censurés ou perdus de vue |
|
Analyse actualisée
Suivi minimum : 62,6 mois |
||
| Survie globalea | ||
| Evénements | 118 (87,4 %) | 133 (97,1 %) |
| Hazard ratio | 0,62 | |
| IC à 95 % | (0,48 ; 0,79) | |
| Taux (IC à 95 %) à 60 mois | 12,3 (7,4 ; 18,5) | 3,6 (1,4 ; 7,8) |
| Réponse objective confirmée | 20,0 % | 8,8 % |
| (IC à 95 %) | (13,6 ; 27,7) | (4,6 ; 14,8) |
| Durée médiane de réponse | ||
| Mois (intervalle) | 25,2 (2,9-70,6+) | 7,5 (0,0 + -18,0 + ) |
| Survie sans progression | ||
| Taux (IC à 95 %) à 60 mois | 9,4 (4,8 ; 15,8) | Tous les patients avaient soit progressé, soit étaient censurés ou perdus de vue |
a Six patients (4 %) randomisés dans le bras docétaxel ont été autorisés à recevoir à un moment donné un
traitement par nivolumab.
“+” Indique une donnée censurée.
Le taux d'amélioration des symptômes liés à la maladie, mesuré par le score
LCSS (Lung Cancer Symptom Score), était similaire
entre le bras nivolumab (18,5 %) et le bras docétaxel (21,2 %). La moyenne EQ-VAS a augmenté au fil du
temps pour les deux groupes de traitement, suggérant un meilleur état de santé
global pour les patients restants sous traitement.
“+” Indique une donnée censurée.
Etude de phase 2 monobras
(CA209063)
L'étude
CA209063 monobras, en ouvert a été menée chez 117
patients avec un CBNPC de type épidermoïde localement avancé ou métastatique
après au moins deux lignes de traitement ; par ailleurs les critères
d'inclusion étaient similaires à ceux appliqués dans l'étude CA209017. Nivolumab 3 mg/kg a montré un ORR de 14,5 % (IC à 95 % :
8,7 à 22,2 %), une survie globale médiane de 8,21 mois (IC à 95 % : 6,05 à 10,9
mois), et une PFS médiane de 1,87 mois (IC à 95 % : 1,77 à 3,15 mois). La PFS a
été mesurée selon les critères RECIST, version 1.1. Le taux de survie estimé à
1 an était de 41 %.
Étude de phase 2 à un bras de traitement (CA209171)
L'étude CA209171 était
une étude en ouvert à un seul bras de traitement par nivolumab
en monothérapie chez des patients atteints d'un CBNPC épidermoïde avancé ou
métastatique préalablement traités. La tolérance était le critère d'évaluation principal
et l'efficacité était un critère d'évaluation secondaire. Sur les 811 patients
traités, 103 (13 %) avaient un score de performance ECOG de 2, 686 (85 %)
étaient âgés de moins de 75 ans et 125 (15 %) étaient âgés de ≥ 75 ans.
Aucun nouveau signal de sécurité n'a été identifié chez tous les patients
traités et le profil de tolérance général du nivolumab
était similaire dans les sous-groupes. Les résultats d'efficacité basés sur
l'ORR évalué par l'investigateur sont présentés dans le Tableau 19 ci-dessous.
Tableau
19 : ORR basé sur les réponses des patients évaluables - en totalité et par
sous-groupe (CA209171)
| Résultats | Total | ECOG 2 | < 75 ans | ≥ 75 ans |
|
N
répondeurs/N évaluablesa (%) |
66/671 (9,8) |
1/64 (6,1) |
55/568 (9,7) |
11/103 (10,7) |
| IC 95 %b | (7,7 ; 12,3) | (0,0 ; 8,4) | (7,4 ; 12,4) | (5,5 ; 18,3) |
a inclut les réponses confirmées et non confirmées, les
scanners étaient obligatoires uniquement aux semaines 8/9 et 52.
b RC + RP, intervalle de confiance basé sur la méthode Clopper et Pearson
b RC + RP, intervalle de confiance basé sur la méthode Clopper et Pearson
CBNPC de type non-épidermoïde
Etude de phase 3 randomisée versus docétaxel
(CA209057)
La tolérance et l'efficacité de nivolumab 3 mg/kg en
monothérapie dans le traitement du CBNPC de type non-épidermoïde localement
avancé ou métastatique ont été évaluées dans une étude de phase 3, randomisée,
en ouvert (CA209057). L'étude a inclus des patients (âgés de 18 ans ou plus)
avec un statut de performance ECOG de 0 ou 1, dont la maladie avait progressé
pendant ou après un traitement antérieur par un doublet
de chimiothérapie à base de sels de platine pouvant inclure un traitement de
maintenance. Une ligne de traitement supplémentaire par ITK était autorisée
chez les patients présentant une mutation connue de l'EGFR ou une translocation
de ALK. Les patients ont été inclus indépendamment du statut PD-L1 de leur
tumeur. Les patients présentant une maladie auto-immune active, une
pneumopathie interstitielle diffuse symptomatique ou des métastases cérébrales
actives ont été exclus de l'étude. Les patients présentant des métastases
cérébrales traitées étaient éligibles si 2 semaines au moins avant l'inclusion
leur état neurologique était revenu à l'état initial, et que soit ils ne
recevaient plus de corticoïdes ou soit ils étaient en phase de stabilisation ou
de décroissance de la corticothérapie à une dose de < 10 mg par jour de prednisolone ou équivalents.
Un total de 582 patients a été randomisé pour recevoir soit nivolumab à la posologie de 3 mg/kg administré sur 60 minutes par voie intraveineuse, toutes les 2 semaines (n = 292), soit docétaxel à la posologie de 75 mg/m2 toutes les 3 semaines (n = 290). Le traitement était poursuivi tant qu'un bénéfice clinique était observé ou jusqu'à ce que le patient ne puisse plus tolérer le traitement. Les évaluations tumorales ont été réalisées selon les critères RECIST version 1.1. Le critère principal était la SG. Les principaux critères secondaires de l'efficacité étaient l'ORR et la SSP évalués par les investigateurs. Des analyses supplémentaires en sous-groupes pré-spécifiées ont été menées pour évaluer l'efficacité de l'expression tumorale de PD-L1 aux niveaux prédéfinis de 1 %, 5 % et 10 %. Une évaluation en fonction des intervalles discrets d'expression de PD-L1 n'a pas été incluse dans les analyses pré-spécifiées en raison de la petite taille des échantillons dans les intervalles.
Des échantillons de tissu tumoral prélevés avant le début de traitement ont été systématiquement recueillis avant la randomisation afin d'effectuer des analyses pré-planifiées de l'efficacité selon l'expression tumorale de PD-L1. L'expression tumorale de PD-L1 était déterminée en utilisant le test PD-L1 IHC 28-8 pharmDx.
L'âge médian était de 62 ans (de 21 à 85 ans), dont 34 % ≥ 65 ans et 7 % ≥ 75 ans. La majorité des patients était de type caucasien (92 %) et de sexe masculin (55 %). Le statut de performance ECOG était de 0 (31 %) ou 1 (69 %). Soixante-dix-neuf pourcent des patients étaient d'anciens ou d'actuels fumeurs.
Les courbes de Kaplan-Meier pour la SG sont présentées dans la Figure 15.
Figure 15 : Courbes de Kaplan-Meier pour la SG (CA209057)
L'étude
a démontré une amélioration statistiquement significative de la SG chez les
patients ayant reçu du nivolumab comparé à ceux ayant
reçu du docétaxel lors de l'analyse intermédiaire
pré-spécifiée après l'observation de 413 événements (93 % du nombre
d'événements prévus pour l'analyse finale).
Les résultats d'efficacité sont montrés dans le Tableau 20.
Tableau 20 : Résultats d'efficacité
(CA209057)
|
nivolumab
(n = 292) |
docétaxel
(n = 290) |
|
|
Analyse
intermédiaire pré-définie
Suivi minimum : 13,2 mois |
||
| Survie globale | ||
| Evénements | 190 (65,1 %) | 223 (76,9 %) |
| Hazard ratioa | 0,73 | |
| IC à 95,92 % | (0,59 ; 0,89) | |
| p-valueb | 0,0015 | |
| Médiane (IC à 95 %) mois | 12,19 (9,66 ; 14,98) | 9,36 (8,05 ;10,68) |
| Taux (IC à 95 %) à 12 mois | 50,5 (44,6 ; 56,1) | 39,0 (33,3 ; 44,6) |
| Réponse objective confirmée | 56 (19,2 %) | 36 (12,4 %) |
| (IC à 95 %) | (14,8 ; 24,2) | (8,8 ; 16,8) |
| Odds ratio (IC à 95 %) | 1,68 (1,07 ; 2,64) | |
| p-value | 0,0246 | |
| Réponse complète (RC) | 4 (1,4 %) | 1 (0,3 %) |
| Réponse partielle (RP) | 52 (17,8 %) | 35 (12,1 %) |
| Maladie stable (MS) | 74 (25,3 %) | 122 (42,1 %) |
| Durée médiane de réponse | ||
| Mois (intervalle) | 17,15 (1,8-22,6+) | 5,55 (1,2+-15,2+) |
| Délai médian de réponse | ||
| Mois (intervalle) | 2,10 (1,2-8,6) | 2,61 (1,4-6,3) |
| Survie sans progression | ||
| Evénements | 234 (80,1%) | 245 (84,5%) |
| Hazard ratio | 0,92 | |
| IC à 95 % | (0,77 ; 1,11) | |
| p-value | 0,3932 | |
| Médiane (IC à 95 %) (mois) | 2,33 (2,17 ; 3,32) | 4,21 (3,45 ; 4.86) |
| Taux (IC à 95 %) à 12 mois | 18,5 (14,1 ; 23,4) | 8,1 (5,1 ; 12,0) |
| Analyse actualisée Suivi minimum : 24,2 mois | ||
| Survie globalec | ||
| Evénements | 228 (78,1 %) | 247 (85,1 %) |
| Hazard ratio a | 0,75 | |
| IC à 95 % | (0,63 ; 0,91) | |
| Taux (IC à 95 %) à 24 mois | 28,7 (23,6 ; 34,0) | 15,8 (11,9 ; 20,3) |
| Réponse objective confirmée | 19,2 % | 12,4 % |
| (IC à 95 %) | (14,8 ; 24,2) | (8,8 ; 16,8) |
| Durée médiane de réponse | ||
| Mois (intervalle) | 17,2 (1,8 - 33,7+) | 5,6 (1.2+ ; 16,8) |
| Survie sans progression Taux (IC à 95 %) à 24 mois | 11,9 (8,3 ; 16,2) | 1,0 (0,2 ; 3,3) |
|
Analyse actualisée Suivi minimum : 62,7 mois |
||
| Survie globaled | ||
| Evénements | 250 (85,6 %) | 279 (96,2 %) |
| Hazard ratio a | 0,70 | |
| IC à 95 % | (0,58 ; 0,83) | |
| Taux (IC à 95 %) à 60 mois | 14,0 (10,2 ; 18,3) | 2,1 (0,9 ; 4,4) |
| Réponse objective confirmée | 19,5 % | 12,4 % |
| (IC à 95 %) | (15,1 ; 24,5) | (8,8 ; 16,8) |
| Durée médiane de réponse | 17,2 (1,8-70,4+) | 5,6 (0,0 +- 33,4) |
| Mois (intervalle) | ||
|
Survie
sans progression Taux (IC à 95 %) à 60 mois |
7,5 (4,5 ; 11,4) | Tous les patients avaient soit progressé, soit étaient censurés ou perdus de vue |
a Dérivé d'un modèle de risque stratifié proportionnel.
b La valeur de p est dérivée d'un test stratifié du log-rank par traitement antérieur d'entretien et par ligne de traitement ; le niveau seuil d'efficacité significatif selon O'Brien-Fleming est de 0,0408.
c Seize patients (6%) randomisés dans le bras docétaxel ont été autorisés à recevoir à un moment donné un traitement par nivolumab.
d Dix-sept patients (6%) randomisés dans le bras docétaxel ont été autorisés à recevoir à un moment donné un traitement par nivolumab.
« + » Indique une donnée censurée
b La valeur de p est dérivée d'un test stratifié du log-rank par traitement antérieur d'entretien et par ligne de traitement ; le niveau seuil d'efficacité significatif selon O'Brien-Fleming est de 0,0408.
c Seize patients (6%) randomisés dans le bras docétaxel ont été autorisés à recevoir à un moment donné un traitement par nivolumab.
d Dix-sept patients (6%) randomisés dans le bras docétaxel ont été autorisés à recevoir à un moment donné un traitement par nivolumab.
« + » Indique une donnée censurée
Une expression tumorale quantifiable de PD-L1 a été mesurée chez 79 % des patients dans le groupe nivolumab et 77 % des patients dans le groupe docétaxel. Les niveaux d'expression tumorale de PD-L1 étaient comparables entre les deux groupes de traitement (nivolumab vs docétaxel) à chaque niveau prédéfini d'expression tumorale de PD-L1, ≥ 1 % (53 % vs 55 %), ≥ 5 % (41 % vs 38 %), ou ≥ 10 % (37 % vs 35 %).
Les patients présentant une expression tumorale de PD-L1 parmi les niveaux d'expression prédéfinis ont montré une plus grande probabilité d'amélioration de la survie globale dans le groupe nivolumab comparé au docétaxel, alors que la survie était similaire au docétaxel chez les patients présentant une absence ou une expression tumorale faible de PD-L1. En termes d'ORR, l'augmentation de l'expression de PD-L1 était associée à un ORR plus important. De façon comparable à la population globale, la durée médiane de réponse était augmentée avec nivolumab versus docétaxel pour les patients sans expression de PD-L1 (18,3 mois vs 5,6 mois) et pour les patients avec une expression de PD-L1 (16,0 mois vs 5,6 mois).
Le Tableau 21 résume les résultats d'ORR et de SG selon l'expression tumorale de PD-L1.
Tableau 21 : ORR et SG selon l'expression tumorale de PD-L1 (CA209057)
| Expression de PD-L1 | nivolumab | docétaxel | |
|
ORR selon l'expression
tumorale de PD-L1
Suivi minimum : 13,2 mois |
|||
| Odds ratio (IC 95 %) | |||
| < 1 % |
10/108
(9,3 %) IC 95 %: 4,5 ; 16,4 |
15/101
(14,9 %) IC 95 %: 8,6 ; 23,3 |
0,59 (0,22 ; 1,48) |
| ≥ 1 % |
38/123
(30,9 %) IC 95 %: 22,9 ; 39,9 |
15/123
(12,2 %) IC 95 %: 7,0 ; 19 ,3 |
3,22 (1,60 ; 6,71) |
| ≥ 1 % à < 10 %a |
6/37
(16,2 %) IC 95 %: 6,2 ; 32,0 |
5/44
(11,4 %) IC 95 %: 3,8 ; 24,6 |
1,51 (0,35 ; 6,85) |
| ≥ 10 % à < 50 %a |
5/20
(25,0 %) IC 95 %: 8,7 ; 49,1 |
7/33
(21,2 %) IC 95 %: 9,0 ; 38,9 |
1,24 (0,26 ; 5,48) |
| ≥ 50 %a |
27/66 (40,9 %) IC 95 %: 29,0 ; 53,7 |
3/46
(6,5 %) IC 95 %: 1.4 ; 17.9 |
9,92 (2,68 ; 54,09) |
|
SG selon l'expression
tumorale de PD-L1
Suivi minimum : 13,2 mois |
|||
| Nombre d'événements (nombre de patients) | Hazard Ratio non stratifié (IC 95 %) | ||
| < 1 % | 77 (108) | 75 (101) | 0,90 (0,66 ; 1,24) |
| ≥ 1 % | 68 (123) | 93 (123) | 0,59 (0,43 ; 0,82) |
| ≥ 1 % à < 10 %a | 27 (37) | 30 (44) | 1,33 (0,79 ; 2,24) |
| ≥ 10 % à < 50 %a | 11 (20) | 26 (33) | 0,61 (0,30 ; 1,23) |
| ≥ 50 %a | 30 (66) | 37 (46) | 0,32 (0,20 ; 0,53) |
| Analyse actualisée Suivi minimum : 24,2 mois | |||
| < 1 % | 91 (108) | 86 (101) | 0,91 (0,67; 1,22) |
| ≥ 1 % | 87 (123) | 103 (123) | 0,62 (0,47; 0,83) |
| Analyse actualisée Suivi minimum : 62,7 mois | |||
| < 1 % | 100 (109) | 96 (101) | 0,87 (0,66 ; 1,16) |
| ≥ 1 % | 96 (122) | 119 (123) | 0,55 (0,42 ; 0,73) |
a Analyse post-hoc ; les résultats doivent être interprétés
avec précaution car les tailles des sous-groupes d'échantillon sont petites, et
au moment de l'analyse, le test PD-L1 IHC 28-8 pharmDx
n'était pas analytiquement validé aux niveaux d'expression de 10 % et 50 %.
Une plus grande proportion de patients est décédée au cours des 3 premiers mois
dans le bras nivolumab (59/292, 20,2 %) comparé au
bras docétaxel (44/290, 15,2 %). Les résultats d'une
analyse post-hoc, exploratoire multivariée, ont indiqué que les patients
traités par nivolumab présentant des caractéristiques
de moins bon pronostic et/ou une maladie agressive, associé à une absence ou
une plus faible expression tumorale de PD-L1 (par exemple < 50 %),
pourraient présenter un risque plus élevé de décès dans les 3 premiers mois.
Dans les analyses en sous-groupes, le bénéfice en survie comparé au docétaxel n'a pas été démontré chez les patients n'ayant jamais fumé ou pour lesquels les tumeurs présentaient des mutations activatrices de l'EGFR ; cependant, en raison du petit nombre de patients, aucune conclusion définitive ne peut être tirée de ces données.
Mésothéliome pleural malin
Étude randomisée de phase 3 avec nivolumab en
association à l'ipilimumab versus chimiothérapie
(CA209743)
La tolérance et l'efficacité de nivolumab 3 mg/kg
toutes les 2 semaines en association à l'ipilimumab 1
mg/kg toutes les 6 semaines ont été évaluées dans une étude de phase 3,
randomisée, en ouvert (CA209743). L'étude a inclus des patients (âgés de 18 ans
ou plus) avec un mésothéliome pleural malin
histologiquement confirmé et non préalablement traité, d'histologie épithélioïde ou nonépithélioïde,
avec un statut de performance ECOG de 0 ou 1, et sans radiothérapie palliative
dans les 14 jours précédant le premier traitement à l'étude. Les patients ont
été inclus indépendamment du statut PD-L1 de leur tumeur.
Les patients présentant un mésothéliome primitif
péritonéal, péricardique, des testicules ou de la tunique vaginale,
pneumopathie interstitielle diffuse, une maladie auto-immune active, des
conditions médicales nécessitant une immunosuppression systémique, et des métastases
cérébrales (à moins d'une résection chirurgicale ou d'une radiothérapie
stéréotaxique, et sans évolution dans les 3 mois précédant l'inclusion dans
l'étude) ont été exclus de l'étude. La randomisation a été stratifiée en
fonction de l'histologie (sous-types épithélioïdesvssarcomatoïdes ou histologie mixte) et du sexe
(masculin vs féminin).
Un total de 605 patients a été randomisé pour recevoir nivolumab
en association à l'ipilimumab (n = 303) ou une
chimiothérapie (n = 302). Les patients du bras nivolumab
en association à l'ipilimumab ont reçu nivolumab 3 mg/kg, administré par voie intraveineuse
pendant 30 minutes toutes les 2 semaines en association à l'ipilimumab
1 mg/kg, administré par voie intraveineuse pendant 30 minutes toutes les 6
semaines pour une durée maximale de 2 ans. Les patients du bras chimiothérapie
ont reçu une chimiothérapie pendant un maximum de 6 cycles (chaque cycle était
de 21 jours). La chimiothérapie comprenait du cisplatine
75 mg/m² et du pémétrexed 500 mg/m², ou du carboplatine (ASC de 5) et du pémétrexed
500 mg/m².
Le traitement a été poursuivi jusqu'à progression de la maladie, toxicité
inacceptable ou jusqu'à 24 mois. Le traitement pouvait se poursuivre après
progression de la maladie si le patient était cliniquement stable et que
l'investigateur considérait qu'il en tirait un bénéfice clinique. Les patients
qui ont arrêté la double immunothérapie en raison d'un événement indésirable
attribué à l'ipilimumab ont été autorisés à
poursuivre le nivolumab en monothérapie. Les évaluations
tumorales ont été réalisées toutes les 6 semaines après la première dose du
traitement à l'étude pendant les 12 premiers mois, puis toutes les 12 semaines
et ce jusqu'à progression de la maladie ou arrêt du traitement à l'étude.
Les caractéristiques des patients à l'inclusion dans l'étude CA209743 étaient
généralement équilibrées entre les différents bras de traitement. L'âge médian
était de 69 ans (de 25 à 89 ans), dont 72 % ≥ 65 ans et 26 % ≥ 75
ans. La majorité des patients était de type caucasien (85 %) et de sexe
masculin (77 %). Le statut de performance ECOG à l'inclusion était de 0 (40 %)
ou de 1 (60 %), 80 % des patients présentaient un statut PD-L1 ≥ 1 % et
20 % un statut PD-L1 < 1 %, 75 % présentaient une histologie épithélioïde et 25 % non épithélioïde
Le critère d'évaluation principal d'efficacité de l'étude CA209743 était la SG. Les principaux critères secondaires d'efficacité étaient la SSP, l'ORR, et la durée de réponse, évalués par un comité de revue centralisé indépendant en aveugle (BICR), en utilisant les critères RECIST modifiés pour le mésothéliome pleural. Des analyses descriptives de ces critères secondaires sont présentées dans le Tableau 21.
L'étude a démontré une amélioration statistiquement significative de la SG des patients randomisés dans le bras nivolumab en association à l'ipilimumab comparé à la chimiothérapie, lors de l'analyse intermédiaire pré-spécifiée, après l'observation d'au moins 419 événements (89 % du nombre prévu d'événements pour l'analyse finale). Le suivi minimum pour la SG était de 22 mois.
Les résultats d'efficacité sont présentés dans la Figure 16 et dans le Tableau 22.
Figure 16 : Courbes de Kaplan-Meier pour la SG (CA209743)
Tableau
22 : Résultats d'efficacité (CA209743)
|
nivolumab + ipilimumab (n = 303) |
chimiothérapie
(n = 302) |
|
| Survie globale | ||
| Evénements | 200 (66 %) | 219 (73 %) |
| Hazard ratio | 0,74 | |
| (IC à 96,6 %)a | (0,60 ; 0,91) | |
| Valeur de p log-rankstratifiéb | 0,002 | |
| Médiane (mois)c | 18,1 | 14,1 |
| (IC à 95 %) | (16,8 ; 21,5) | (12,5 ; 16,2) |
| Taux (IC à 95 %) à 24 moisc | 41 % (35,1 ; 46,5) | 27 % (21,9 ; 32,4) |
| Survie sans progression | ||
| Evénements | 218 (72 %) | 209 (69 %) |
| Hazard ratio | 1,0 | |
| (IC à 95 %)a | (0,82 ; 1,21) | |
| Médiane (mois)c | 6,8 | 7,2 |
| (IC à 95 %) | (5,6 ; 7,4) | (6,9 ; 8,1) |
| Taux de réponse objective | 40 % | 43 % |
| (IC à 95 %) | (34,1 ; 45,4) | (37,1 ; 48,5) |
| Réponse complète (RC) | 1,7% | 0 |
| Réponse partielle (RP) | 38 % | 43 % |
| Durée de réponse | ||
| Médiane (mois)c | 11,0 | 6,7 |
| (IC à 95 %) | (8,1 ; 16,5) | (5,3 ; 7,1) |
a Modèle à risques proportionnels de Cox stratifié.
b La valeur p est comparée à l'alpha attribué de 0,0345 pour cette analyse intermédiaire.
c Estimation de Kaplan-Meier.
b La valeur p est comparée à l'alpha attribué de 0,0345 pour cette analyse intermédiaire.
c Estimation de Kaplan-Meier.
44,2 % et 40,7 % des patients ont reçu un traitement systémique ultérieur dans les bras en association et chimiothérapie, respectivement. Une immunothérapie ultérieure (incluant anti-PD-1, anti-PD-L1, et anti-CTLA-4) a été reçue par 3,3 % et 20,2 % des patients dans les bras en association et chimiothérapie, respectivement.
Le Tableau 23 résume les résultats d'efficacité de SG, la SSP et l'ORR par histologie dans les analyses pré-spécifiées en sous-groupes.
Tableau 23 : Résultats d'efficacité par histologie (CA209743)
| Epithélioïde (n = 471) | Non-épithélioïde (n = 134) | |||
|
nivolumab
+ ipilimumab (n = 236) |
chimiothérapie
(n = 235) |
nivolumab
+ ipilimumab (n = 67) |
chimiothérapie
(n = 67) |
|
| Survie globale | ||||
| Evénements | 157 | 164 | 43 | 55 |
|
Hazard ratio (IC à 95 %)a |
0,85 (0,68 ; 1,06) |
0.46 (0,31 ; 0,70) |
||
|
Médiane (mois) (IC à 95 % CI) |
18,73 (17,05 ; 21,72) |
16,23 (14,09 ; 19,15) |
16,89 (11,83 ; 25,20) |
8,80 (7,62 ; 11,76) |
|
Taux (IC 95%) à 24 mois |
41,2 (34,7 ; 47,6) |
31,8 (25,7 ; 38,1) |
39,5 (27,5 ; 51,2) |
9,7 (3,8 ; 18,9) |
| Survie sans progression | ||||
|
Hazard ratio (IC à 95 %)a |
1,14 (0,92 ; 1,41) |
0,58 (0,38 ; 0,90) |
||
|
Médiane (mois) (IC à 95 %) |
6,18 (5,49 ; 7.03) |
7,66 (7,03 ; 8,31) |
8,31 (3,84 ; 11,01) |
5,59 (5,13 ; 7,16) |
| Taux de réponse objective | 38,6 % | 47,2 % | 43,3 % | 26,9 % |
| (IC à 95 %)b | (32,3 ; 45,1) | (40,7 ; 53,8) | (31,2 ; 56,0) | (16,8 ; 39,1) |
| Durée de réponse | 8,44 | 6,83 | 24,02 | 4,21 |
|
Médiane (mois) (IC à 95 %)c |
(7,16 ; 14,59) | (5,59 ; 7,13) | (8,31 ; N.A.) | (2,79 ; 7,03) |
a Rapport des risques basé sur le modèle à risques
proportionnels de Cox non stratifié
b Intervalle de confiance basé sur la méthode de Clopper et Pearson
c Médiane calculée selon la méthode de Kaplan-Meier
b Intervalle de confiance basé sur la méthode de Clopper et Pearson
c Médiane calculée selon la méthode de Kaplan-Meier
Le Tableau 24 résume les résultats d'efficacité de SG, la SSP et l'ORR selon l'expression tumorale de PD-L1 à l'inclusion dans les analyses pré-spécifiées en sous-groupes.
Tableau 24 : Résultats d'efficacité selon l'expression tumorale de PD-L1 (CA209743)
|
PD-L1 < 1
%
(n = 135) |
PD-L1 ≥ 1
%
(n = 451) |
|||
|
nivolumab
+ ipilimumab (n = 57) |
chimiothérapie
(n = 78) |
nivolumab
+ ipilimumab (n = 232) |
chimiothérapie
(n = 219) |
|
| Survie globale | ||||
| Evénements | 40 | 58 | 150 | 157 |
|
Hazard ratio (IC à 95 %)a |
0,94 (0,62 ; 1,40) |
0,69 (0,55 ; 0,87) |
||
|
Médiane (mois) (IC à 95 %)b |
17,3
(10,1 ; 24,3) |
16,5
(13,4 ; 20,5) |
18,0
(16,8 ; 21,5) |
13.3
(11,6 ; 15,4) |
|
Taux (IC à 95 %) à 24 mois |
38,7
(25,9 ; 51,3) |
24,6
(15,5 ; 35,0) |
40,8
(34,3 ; 47,2) |
28,3
(22,1 ; 34,7) |
| Survie sans progression | ||||
|
Hazard ratio (IC à 95 %)a |
1,79 (1,21 ; 2,64) |
0,81 (0,64 ; 1,01) |
||
|
Médiane (mois) (ICà 95 %)b |
4,1
(2,7 ; 5,6) |
8,3
(7,0 ; 11,1) |
7,0
(5,8 ; 8,5) |
7,1
(6,2 ; 7,6) |
| Taux de réponse objective | 21,1 % | 38,5 % | 43,5 % | 44,3 % |
| (IC à 95 %)c | (11,4 ; 33,9) | (27,7 ; 50,2) | (37,1 ; 50,2) | (37,6 ; 51,1) |
a Rapport des risques basé sur le modèle à risques
proportionnels de Cox non stratifié
b Médiane calculée selon la méthode de Kaplan-Meier
c Intervalle de confiance basé sur la méthode de Clopper et Pearson
b Médiane calculée selon la méthode de Kaplan-Meier
c Intervalle de confiance basé sur la méthode de Clopper et Pearson
Un total de 157 patients atteints de MPM et âgés de ≥ 75 ans a été inclus dans l'étude CA209743 (78 dans le bras nivolumab en association à l'ipilimumab et 79 dans le bras chimiothérapie). Un HR de 1,02 (IC 95 % : 0,70 ; 1,48) en SG a été observé pour nivolumab en association à l'ipilimumab vs. chimiothérapie au sein de ce sous-groupe d'étude. Un taux plus élevé d'effets indésirables graves et d'arrêt de traitement dû à des effets indésirables a été montré chez les patients âgés de 75 ans ou plus comparé à l'ensemble des patients ayant reçu du nivolumab en association à l'ipilimumab (voir rubrique 4.8). Cependant, compte tenu de la nature exploratoire de cette analyse en sous-groupe, aucune conclusion définitive ne peut être tirée.
Carcinome à cellules rénales
Étude de phase 3 randomisée avec nivolumab
en monothérapie versus évérolimus (CA209025)
La tolérance et
l'efficacité de nivolumab 3 mg/kg en monothérapie
dans le traitement du CCR avancé avec une composante à cellules claires ont été
évaluées dans une étude de Phase 3, randomisée, en ouvert (CA209025). L'étude a
inclus des patients (âgés de 18 ans ou plus) dont la maladie avait progressé
pendant ou après 1 ou 2 traitements anti-angiogéniques
antérieurs et pas plus de 3 traitements systémiques antérieurs au total. Les
patients devaient avoir un Score de Performance de Karnofsky
(KPS) ≥ 70 %. Cette étude a inclus des patients indépendamment du statut
PD-L1 de leur tumeur. Les patients présentant des antécédents ou ayant des
métastases cérébrales, ayant reçu un traitement antérieur avec un inhibiteur de
mTOR (cible de la rapamycine
chez les mammifères), ayant une maladie auto-immune active, ou des conditions
médicales nécessitant une immunosuppression systémique ont été exclus de
l'étude clinique.
Un
total de 821 patients a été randomisé pour recevoir soit nivolumab
à la posologie de 3 mg/kg (n = 410) administré sur 60 minutes par voie
intraveineuse, toutes les 2 semaines, soit évérolimus
(n = 411) à la posologie de 10 mg par jour, administré par voie orale. Le
traitement était poursuivi tant qu'un bénéfice clinique était observé ou
jusqu'à ce que le patient ne puisse plus tolérer le traitement.
Les premières évaluations tumorales ont été réalisées 8 semaines après la
randomisation et ont été poursuivies toutes les 8 semaines au cours de la
première année, puis toutes les 12 semaines jusqu'à progression ou arrêt du
traitement, selon ce qui survient le plus tard. Les évaluations tumorales ont
été poursuivies après l'arrêt du traitement chez les patients qui avaient
arrêté le traitement pour des raisons autres que la progression. Le traitement
au-delà de la progression initiale évaluée par l'investigateur selon les
critères RECIST, version 1.1, était autorisé tant que, selon le jugement de
l'investigateur, le patient avait un bénéfice clinique et tolérait le
traitement à l'étude. Le critère principal était la SG. Les critères
secondaires d'évaluation de l'efficacité étaient l'ORR et la SSP évaluées par
l'investigateur.
Les
caractéristiques à l'inclusion étaient généralement comparables entre les deux
bras. L'âge médian était de 62 ans (de 18 à 88 ans), dont 40 % ≥ 65 ans
et 9 % ≥ 75 ans. La majorité des patients était de sexe masculin (75 %)
et de type caucasien (88 %), l'ensemble des groupes à risque du MSKCC (MemorialSloanKettering Cancer Center) étaient représentés, et 34 % et 66
% des patients avaient un score KPS compris entre 70 et 80 % et entre 90 et 100
%, respectivement. La majorité des patients (72 %) avaient reçu une ligne de
traitement anti-angiogénique antérieure. La durée
médiane entre le diagnostic initial et la randomisation était de 2,6 ans dans
les 2 groupes nivolumab et évérolimus.
La durée médiane de traitement était 5,5 mois (de 0 à 29,6 mois+) chez les
patients traités par nivolumab et 3,7 mois (de 6
jours à 25,7 mois+ ) chez les patients traités par évérolimus.
Nivolumab a été poursuivi au-delà de la progression
chez 44 % des patients.
Les courbes de Kaplan-Meier pour la SG sont présentées dans la Figure 17.
Figure 17 : Courbes de Kaplan-Meier pour la SG (CA209025)
L'étude
a démontré une amélioration statistiquement significative de la SG chez les
patients ayant reçu du nivolumab comparé à ceux ayant
reçu évérolimus lors de l'analyse intermédiaire
pré-spécifiée, après l'observation de 398 événements (70 % du nombre
d'événements prévus pour l'analyse finale) (Tableau 25 et Figure 17). Un
bénéfice en termes de SG a été observé indépendamment du niveau d'expression de
PD-L1 de la tumeur.
Les résultats d'efficacité sont présentés dans le Tableau 25.
Tableau
25 : Résultats d'efficacité (CA209025)
|
nivolumab
(n = 410) |
évérolimus
(n = 411) |
|
| Survie globale | ||
| Evénements | 183 (45 %) | 215 (52 %) |
| Hazard ratio | 0,73 | |
| IC à 98,52 % | (0,57 ; 0,93) | |
| p-value | 0,00018 | |
| Médiane (IC à 95 %) | 25,0 (21,7 ; NE) | 19,6 (17,6 ; 23,1) |
| Taux (IC à 95 %) | ||
| A 6 mois | 89,2 (85,7 ; 91,8) | 81,2 (77,0 ; 84,7) |
| A 12 mois | 76,0 (71,5 ; 79,9) | 66,7 (61,8 ; 71,0) |
| Réponse objective confirmée | 103 (25,1 %) | 22 (5,4 %) |
| (IC à 95 %) | (21,0 ; 29,6) | (3,4 ; 8,0) |
| Odds ratio (IC à 95 %) | 5,98 (3,68 ; 9,72) | |
| p-value | 0,0001 | |
| Réponse complète (RC) | 4 (1,0 %) | 2 (0,5 %) |
| Réponse partielle (RP) | 99 (24,1 %) | 20 (4,9 %) |
| Maladie stable (MS) | 141 (34,4 %) | 227 (55,2 %) |
| Durée médiane de réponse | ||
| Mois (intervalle) | 11,99 (0,0 - 27,6+) | 11,99 (0,0+ - 22,2+) |
| Délai médian de réponse | ||
| Mois (intervalle) | 3,5 (1,4 - 24,8) | 3,7 (1,5 - 11,2) |
| Survie sans progression | ||
| Evénements | 318 (77,6 %) | 322 (78,3 %) |
| Hazard ratio | 0,88 | |
| IC à 95 % | (0,75 ; 1,03) | |
| p-value | 0,1135 | |
| Médiane (IC à 95 %) (mois) | 4,6 (3,71 ; 5,39) | 4,4 (3,71 ; 5,52) |
« + »
Indique une donnée censurée
NE = non estimable
NE = non estimable
Le délai médian de survenue de la réponse objective était de 3,5 mois (de 1,4 à 24,8 mois) après le début du traitement par nivolumab. Quarante-neuf (47,6 %) répondeurs avaient des réponses en cours avec une durée allant de 0,0 à 27,6 mois+.
La survie globale pouvait être accompagnée d'une amélioration avec le temps des symptômes liés à la maladie et de la QdV non spécifique à la maladie évaluée par les échelles valides et fiables de FKSIDRS (FunctionalAssessment of Cancer Therapy-KidneySymptom Index-DiseaseRelatedSymptoms) et EuroQoL EQ-5D. L'amélioration apparemment significative des symptômes (MID = 2 points de changement dans le score de FKSI-DRS ; p < 0,001) et le délai jusqu'à amélioration (HR = 1,66 (1,33 ; 2,08), p < 0,001) étaient significativement meilleurs pour les patients du bras nivolumab. Bien que les patients des deux bras de l'étude aient reçu un traitement actif, les données de QoL doivent être interprétées dans le contexte d'une étude en ouvert et par conséquent être prises avec précaution.
Étude de tolérance de phase 3b/4 (CA209374)
L'étude
CA209374, étude de phase 3b/4 en ouvert évaluant la tolérance de nivolumab en monothérapie (à la posologie de 240 mg toutes
les 2 semaines), apporte des données supplémentaires de tolérance et descriptives
d'efficacité chez des patients atteints d'un RCC avancé ou métastatique (n =
142), incluant 44 patients avec une histologie non à cellules claires.
Chez les sujets avec une histologie non à cellules claires, l'ORR et de la durée médiane de réponse étaient respectivement de 13,6 % et de 10,2 mois, avec un suivi minimum d'approximativement 16,7 mois. Une activité clinique a été observée indépendamment du statut d'expression tumorale de PD-L1.
Étude de Phase 3, randomisée, avec nivolumab
en association à l'ipilimumab versus sunitinib (CA209214)
La
tolérance et l'efficacité du nivolumab 3 mg/kg en
association à l'ipilimumab 1 mg/kg dans le traitement
du CCR avancé/métastatique ont été évaluées dans une étude de phase 3,
randomisée, en ouvert (CA209214). L'étude a inclus des patients (âgés de 18 ans
et plus) atteints d'un carcinome à cellules rénales avancé ou métastatique,
avec une composante à cellules claires, non précédemment traité. La population
évaluée dans le cadre du critère principal d'efficacité était composée de
patients de pronostic intermédiaire/défavorable présentant au moins 1 des 6
facteurs de risque pronostique selon les critères de l'International Metastatic RCC Database
Consortium (IMDC) (intervalle de moins d'un an entre le diagnostic initial de
carcinome à cellules rénales et la randomisation, indice de performance de Karnofsky < 80 %, taux d'hémoglobine sous la limite
inférieure à la normale, taux de calcium corrigé supérieur à 10 mg/dL, numération plaquettaire supérieure à la limite supérieure
de la normale et numération absolue des neutrophiles plus élevée que la limite
supérieure de la normale). Cette étude a inclus les patients indépendamment du
statut d'expression de PD-L1 de la tumeur. Les patients dont l'indice de
performance de Karnofsky était < 70 % et les
patients ayant des antécédents de métastases cérébrales ou des métastases
cérébrales concomitantes, une maladie auto-immune active ou une pathologie
médicale nécessitant une immunosuppression systémique ont été exclus de
l'étude. Les patients ont été stratifiés en fonction du score pronostique IMDC
et de la région.
Un total de 1 096 patients a été randomisé dans l'étude, dont 847 présentaient un CCR de pronostic intermédiaire/défavorable et ont reçu soit nivolumab 3 mg/kg (n = 425) administré par voie intraveineuse sur 60 minutes en association à l'ipilimumab 1 mg/kg administré par voie intraveineuse sur 30 minutes toutes les 3 semaines pendant 4 cycles suivis par nivolumab 3 mg/kg en monothérapie toutes les 2 semaines, soit du sunitinib (n = 422) à raison de 50 mg par jour, administré par voie orale pendant 4 semaines suivi d'une fenêtre thérapeutique de 2 semaines, par cycle. Le traitement était poursuivi tant qu'un bénéfice clinique était observé ou jusqu'à ce que le patient ne puisse plus tolérer le traitement. Les premières évaluations tumorales ont été menées 12 semaines après la randomisation et ont été poursuivies toutes les 6 semaines au cours de la première année, puis toutes les 12 semaines jusqu'à progression ou arrêt du traitement, selon ce qui survient le plus tard. Le traitement au-delà de la progression initiale évaluée par l'investigateur selon la définition RECIST, version 1.1 était autorisé tant que, selon le jugement de l'investigateur, le patient avait un bénéfice clinique et tolérait le traitement à l'étude. Les critères principaux d'évaluation de l'efficacité étaient la SG, l'ORR et la SSP chez les patients de pronostic intermédiaire/défavorable, déterminée par un BICR.
Les caractéristiques à l'inclusion étaient généralement comparables entre les deux bras. L'âge médian était de 61 ans (de 21 à 85 ans) dont 38 % ≥ 65 ans et 8 % ≥ 75 ans. La majorité des patients était de sexe masculin (73 %) et de type caucasien (87%), et 31 % et 69 % des patients avaient un score KPS initial de 70 à 80 % et de 90 à 100 %, respectivement. La durée médiane du délai entre le diagnostic initial et la randomisation était de 0,4 an dans les deux groupes, nivolumab 3 mg/kg en association à l'ipilimumab 1 mg/kg et sunitinib. La durée médiane du traitement était de 7,9 mois (de 1 jour à 21,4+ mois) chez les patients traités par nivolumab et ipilimumab et de 7,8 mois (de 1 jour à 20,2+ mois) chez les patients traités par sunitinib. 29 % des patients traités dans le bras nivolumab et ipilimumab ont poursuivis leur traitement au-delà de la progression.
Les
résultats d'efficacité chez les patients de pronostic intermédiaire/défavorable
sont illustrés dans le Tableau 26 analyse principale avec un suivi minimum de
17,5 mois et avec un suivi minimum de 60 mois) et dans la Figure 18 (suivi
minimum de 60 mois).
Les résultats de SG de l'analyse descriptive additionnelle réalisée avec un
suivi minimum de 60 mois montrent des résultats cohérents avec l'analyse
principale initiale.
Tableau
26 : Résultats d'efficacité chez les patients de pronostic
intermédiaire/défavorable (CA209214)
|
nivolumab + ipilimumab (n = 425) |
sunitinib
(n = 422) |
|
| Analyse
principale
suivi minimum : 17,5 mois |
||
| Survie globale | ||
| Evènements | 140 (33 %) | 188 (45 %) |
| Hazard ratioa | 0,63 | |
| IC à 99,8 % | (0,44 ; 0,89) | |
| p-valueb, c | < 0,0001 | |
| Médiane (IC à 95 %) | NE (28,2 ; NE) | 25,9 (22,1 ; NE) |
| Taux (IC à 95 %) | ||
| A 6 mois | 89,5 (86,1 ; 92,1) | 86,2 (82,4 ; 89,1) |
| A 12 mois | 80,1 (75,9 ; 83,6) | 72,1 (67,4 ; 76,2) |
| Survie sans progression | ||
| Evènement | 228 (53,6 %) | 228 (54,0 %) |
| Hazard ratioa | 0,82 | |
| IC à 99,1 % | (0,64 ; 1,05) | |
| p-valueb,h | 0,0331 | |
| Médiane (IC à 95%) | 11,6 (8,71 ; 15,51) | 8,4 (7,03 ; 10,81) |
| Réponse objective confirmée (RCIA) | 177 (41,6 %) | 112 (26,5 %) |
| (IC à 95 %) | (36,9 ; 46,5) | (22,4 ; 31,0) |
| Différence d'ORR (IC à 95 %)d | 16,0 (9,8 ; 22,2) | |
| p-valuee,f | < 0,0001 | |
| Réponse complète (RC) | 40 (9,4 %) | 5 (1,2 %) |
| Réponse partielle (RP) | 137 (32,2 %) | 107 (25,4 %) |
| Maladie stable (MS) | 133 (31,3 %) | 188 (44,5 %) |
| Durée médiane de réponseg | ||
| Mois (intervalle) | NE (1,4+ ; 25,5+) | 18,17 (1,3+ ; 23,6+) |
| Délai médian de réponse | ||
| Mois (intervalle) | 2,8 (0,9 ; 11,3) | 3,0 (0,6 ; 15,0) |
| Analyse
actualisée*
suivi minimum : 60 mois |
||
| Survie globale | ||
| Evènements | 242 (57 %) | 282 (67 %) |
| Hazard ratioa | 0,68 | |
| IC à 95 % | (0,58 ; 0,81) | |
| Médiane (IC à 95 %) | 46,95 (35,35 ; 57,43) | 26,64 (22,08 ; 33,54) |
| Taux (IC à 95 %) | ||
| A 24 mois | 66,3 (61,5 ; 70,6) | 52,4 (47,4 ; 57,1) |
| A 36 mois | 54,6 (49,7 ; 59,3) | 43,7 (38,7 ; 48,5) |
| A 48 mois | 49,9 (44,9 ; 54,6) | 35,8 (31,1 ; 40,5) |
| A 60 mois | 43,0 (38,1 ; 47,7) | 31,3 (26,8 ; 35,9) |
| Survie sans progression | ||
| Evènements | 245 (57,6 %) | 253 (60,0 %) |
| Hazard ratioa | 0,73 | |
| IC à 95 % | (0,61 ; 0,87) | |
| Médiane (IC à 95 %) | 11,6 (8,44 ; 16,63) | 8,3 (7,03 ; 10,41) |
| Réponse objective confirmée (RCIA) | 179 (42,1 %) | 113 (26,8 %) |
| (IC à 95 %) | (37,4 ; 47,0) | (22,6 ; 31,3) |
| Différence d'ORR (IC à 95 %)d,e | 16,2 (10,0 ; 22,5) | |
| Réponse complète (RC) | 48 (11,3 %) | 9 (2,1 %) |
| Réponse partielle (RP) | 131 (30,8 %) | 104 (24,6 %) |
| Maladie stable (MS) | 131 (30,8 %) | 187 (44,3 %) |
| Durée médiane de réponseg | ||
| Mois (intervalle) | NE (50,89 ; NE) | 19,38 (15,38 ; 25,10) |
| Délai médian de réponse | ||
| Mois (intervalle) | 2,8 (0,9 ; 35,0) | 3,1 (0,6 ; 23,6) |
a Sur la base d'un modèle stratifié à risques proportionnels.
b Sur la base d'un test du log-rank stratifié.
c La p-value est comparée à l'alpha 0,002 pour atteindre la significativité statistique.
d Différence ajustée sur les strates.
e Sur la base du test stratifié selon DerSimonian-Laird.
f La p-value est comparée à l'alpha 0,001 pour atteindre la significativité statistique.
g Calculé selon de la méthode de Kaplan-Meier.
h La p-value est comparée à l'alpha 0,009 pour atteindre la significativité statistique.
“+ ” indique une donnée censurée.
NE = non estimable
* Analyse descriptive (cut-off des données 26 février 2021).
b Sur la base d'un test du log-rank stratifié.
c La p-value est comparée à l'alpha 0,002 pour atteindre la significativité statistique.
d Différence ajustée sur les strates.
e Sur la base du test stratifié selon DerSimonian-Laird.
f La p-value est comparée à l'alpha 0,001 pour atteindre la significativité statistique.
g Calculé selon de la méthode de Kaplan-Meier.
h La p-value est comparée à l'alpha 0,009 pour atteindre la significativité statistique.
“+ ” indique une donnée censurée.
NE = non estimable
* Analyse descriptive (cut-off des données 26 février 2021).
Figure 18 : Courbes de Kaplan-Meier de la SG chez les patients de pronostic intermédiaire/défavorable (CA209214) – Suivi minimum de 60 mois
Une analyse descriptive actualisée de la SG a été réalisée quand tous les patients avaient atteint un suivi minimum de 24 mois. Au moment de l'analyse, le hazard ratio était de 0,66 (IC à 99,8 % de 0,48 à 0,91) avec 166/425 évènements dans le bras en association et 209/422 évènements dans le bras sunitinib. Chez les patients de pronostic intermédiaire/ défavorable, un bénéfice en termes de SG a été observé dans le bras nivolumab en association à l'ipilimumab versus sunitinib, indépendamment de l'expression de PD-L1 de la tumeur. La médiane de SG chez les patients dont l'expression tumorale de PD-L1 ≥ 1 % n'était pas atteinte dans le bras nivolumab en association à l'ipilimumab et était de 19,61 mois dans le bras sunitinib (HR = 0,52 ; IC à 95 % de 0,34 à 0,78). Chez les patients dont l'expression tumorale de PD-L1 < 1 %, la médiane de SG était de 34,7 mois dans le bras nivolumab en association à l'ipilimumab et de 32,2 mois dans le bras sunitinib (HR = 0,70 ; IC à 95 % de 0,54 à 0,92).
249 patients de pronostic favorable selon les critères IMDC ont également été randomisés dans l'étude CA209214 pour recevoir nivolumab plus ipilimumab (n = 125) ou sunitinib (n = 124). Ces patients n'ont pas été pris en compte dans le cadre de la population évaluée dans le critère principal d'efficacité. Avec un suivi minimum de 24 mois, le hazard ratio de la SG chez les patients de pronostic favorable recevant nivolumab plus ipilimumab, par comparaison au bras sunitinib, était de 1,13 (IC à 95 % de 0,64 à 1,99 ; p = 0,6710). Avec un suivi minimum de 60 mois, le hazard ratio de la SG était de 0,94 (IC à 95 % de 0,65 à 1,37).
Il n'y a pas de données sur l'utilisation en première ligne de nivolumab en association à l'ipilimumab chez les patients présentant seulement une histologie non à cellules claires dans le CCR.
Les patients ayant ≥ 75 ans représentaient 8 % des patients de pronostic intermédiaire/défavorable dans l'étude CA209214, et l'association de nivolumab et ipilimumab a montré numériquement un effet moindre sur la SG (HR 0,97 ; IC à 95 % de 0,48 à 1,95) dans ce sous-groupe que dans la population générale avec un suivi minimum de 17,5 mois. En raison du faible effectif de ce sous-groupe, aucune conclusion définitive ne peut être tirée de ces données.
Étude de phase 3, randomisée, avec nivolumab
en association au cabozantinib versus sunitinib (CA2099ER)
La tolérance et l'efficacité du nivolumab 240 mg en association au cabozantinib
40 mg en première ligne du traitement du CCR avancé/métastatique ont été
évaluées dans une étude de phase 3, randomisée, en ouvert (CA2099ER). L'étude a
inclus des patients (âgés de 18 ans et plus) atteints d'un carcinome à cellules
rénales avancé ou métastatique, avec une composante à cellules claires, un
indice de performance de Karnofsky (KPS) ≥ 70
%, et une progression de la maladie mesurable selon la définition RECIST v1.1,
indépendamment du statut d'expression de PD-L1 ou du groupe de risque IMDC. Les
patients présentant une maladie auto-immune ou une condition médicale
nécessitant une immunosuppression systémique, les patients précédemment traités
par un anticorps anti-PD1, anti PD-L1. Les, anti PD-L2, anti-CD137, ou
anti-CTLA-4, les patients présentant une hypertension insuffisamment contrôlée
malgré un traitement anti-hypertenseur, les patients
présentant des métastases cérébrales actives et une insuffisance surrénalienne
non contrôlée ont été exclus de l'étude patients ont été stratifiés en fonction
selon le score pronostique IMDC, le statut d'expression PDL1 de la tumeur et de
la région géographique.
Un total de 651 patients a été randomisé pour recevoir soit nivolumab 240 mg (n = 323) administré par voie intraveineuse toutes les 2 semaines en association au cabozantinib 40 mg une fois par jour par voie orale soit sunitinib (n = 328) 50 mg par jour, administré par voie orale pendant 4 semaines suivi d'une fenêtre thérapeutique de 2 semaines. Le traitement était poursuivi jusqu'à progression de la maladie ou jusqu'à ce que le patient ne puisse plus tolérer le traitement, avec une administration du nivolumab jusqu'à 24 mois. Le traitement au-delà de la progression initiale évaluée par l'investigateur selon les critères RECIST version 1.1 était autorisé tant que, selon le jugement de l'investigateur, le patient avait un bénéfice clinique et tolérait le traitement à l'étude. Les premières évaluations tumorales ont été menées 12 semaines (± 7 jours) après la randomisation. Les évaluations tumorales suivantes ont eu lieu toutes les 6 semaines (± 7 jours) jusqu'à la Semaine 60, puis toutes les 12 semaines (± 14 jours) jusqu'à progression radiographique, confirmée par un BICR. Le critère principal d'évaluation de l'efficacité était la SSP, déterminée par un BICR. Les évaluations additionnelles de l'efficacité incluaient la SG et l'ORR en tant que critères secondaires principaux.
Les caractéristiques à l'inclusion étaient généralement comparables entre les deux bras. L'âge médian était de 61 ans (de 28 à 90 ans) dont 38,4 % ≥ 65 ans et 9,5 % ≥ 75 ans. La majorité des patients était de sexe masculin (73,9 %) et de type caucasien (81,9 %). Huit pour cent des patients étaient d'origine asiatique, 23,2 % et 76,5 % des patients présentaient respectivement un score KPS initial de 70 à 80 % et de 90 à 100 %. La répartition des patients selon les catégories de risque IMDC était 22,6 % pour la catégorie favorable, 57,6 % intermédiaire, et 19,7 % défavorable. Pour la répartition selon le statut d'expression de PD-L1, 72,5 % des patients avaient une expression de PD-L1 < 1 % ou indéterminée, et 24,9 % des patients avaient une expression de PD-L1 ≥ 1 %. 11,5 % des patients présentaient une tumeur avec des caractéristiques sarcomatoïdes. La durée médiane de traitement était de 14,26 mois (de 0,2 à 27,3 mois) chez les patients traités par nivolumab en association au cabozantinib et de 9,23 mois (de 0,8 à 27,6 mois) chez les patients traités par sunitinib.
L'étude a démontré un bénéfice statistiquement significatif en SSP, SG et ORR chez les patients traités par nivolumab en association au cabozantinib comparé au sunitinib. Les résultats d'efficacité issus de l'analyse principale (durée minimum de suivi de 10,6 mois ; durée médiane de suivi de 18,1 mois) sont présentés dans le Tableau 27.
Tableau
27 : Résultats d'efficacité (CA2099ER)
|
nivolumab + cabozantinib (n = 323) |
sunitinib
(n = 328) |
|
| Survie sans progression | ||
| Evènements | 144 (44,6 %) | 191 (58,2 %) |
| Hazard ratioa | 0,51 | |
| IC à 95 % | (0,41 ; 0,64) | |
| p‑valueb, c | < 0,0001 | |
| Médiane (IC à 95 %)d | 16,59 (12,45 ; 24,94) | 8,31 (6,97 ; 9,69) |
| Survie globale | ||
| Evènements | 67 (20,7 %) | 99 (30,2 %) |
| Hazard ratioa | 0,60 | |
| IC à 98.89 % | (0,40 ; 0,89) | |
| p‑valueb,c,e | 0,0010 | |
| Médiane (IC à 95 %) | N.E. | N.E. (22,6 ; N.E.) |
| Taux (IC à 95 %) | ||
| A 6 mois | 93,1 (89,7 ; 95.4) | 86,2 (81,9 ; 89,5) |
| Réponse objective confirmée (RCIA) | 180 (55,7 %) | 89 (27,1 %) |
| (IC à 95 %)f | (50,1 ; 61,2) | (22,4 ; 32,3) |
| Différence d'ORR (IC à 95 %) g | 28,6 (21,7 ; 35,6) | |
| p‑valueh | < 0,0001 | |
| Réponse complète (RC) | 26 (8,0 %) | 15 (4,6 %) |
| Réponse partielle (RP) | 154 (47,7 %) | 74 (22,6 %) |
| Maladie stable (MS) | 104 (32,2 %) | 138 (42,1 %) |
| Durée médiane de réponsed | ||
| Mois (intervalle) | 20,17 (17,31 ; N.E.) | 11,47 (8,31 ; 18,43) |
| Délai médian de réponse | ||
| Mois (intervalle) | 2,83 (1,0‑19,4) | 4,17 (1,7‑12,3) |
a Hazard ratio calculé à partir d'un modèle de Cox à risque
proportionnel stratifié. Le hazard ratio est présenté
pour la comparaison nivolumab en association au cabozantinib versus sunitinib.
b Sur la base d'un test du log-rank stratifié selon le score pronostique IMDC (0, 1-2, 3-6), le statut d'expression tumorale de PD-L1 (≥ 1 % versus < 1 % ou indéterminé) et de la région géographique (Etats-Unis/Canada/Europe de l'Ouest / Europe du Nord, Reste du Monde) comme défini dans l'IRT.
c p-values bilatérales sur la base d'un test du log-rank stratifié.
d Calculé selon la méthode de Kaplan-Meier.
e Limite de significativité statistique p-value < 0,0111.
f IC basé sur la méthode de Clopper et Pearson.
g Différence ajustée sur les strates pour le taux de réponse objective (nivolumab + cabozantinib - sunitinib) sur la base du test de DerSimonian and Laird.
h p-values bilatérales sur la base d'un test Cochran-Mantel-Haenszel.
NE = Non estimable
b Sur la base d'un test du log-rank stratifié selon le score pronostique IMDC (0, 1-2, 3-6), le statut d'expression tumorale de PD-L1 (≥ 1 % versus < 1 % ou indéterminé) et de la région géographique (Etats-Unis/Canada/Europe de l'Ouest / Europe du Nord, Reste du Monde) comme défini dans l'IRT.
c p-values bilatérales sur la base d'un test du log-rank stratifié.
d Calculé selon la méthode de Kaplan-Meier.
e Limite de significativité statistique p-value < 0,0111.
f IC basé sur la méthode de Clopper et Pearson.
g Différence ajustée sur les strates pour le taux de réponse objective (nivolumab + cabozantinib - sunitinib) sur la base du test de DerSimonian and Laird.
h p-values bilatérales sur la base d'un test Cochran-Mantel-Haenszel.
NE = Non estimable
L'analyse principale de la SSP a inclus une censure des nouveaux traitements anticancéreux (Tableau 26). Les résultats pour la SSP avec et sans censure pour les nouveaux traitements anticancéreux étaient cohérents Une proportion plus élevée de patients est décédée au cours des 2,5 premiers mois dans le bras nivolumab (32/210 ; 15,2%), comparé au bras chimiothérapie (15/209 ; 7,2%). Aucun facteur spécifique associé à ces décès précoces n'a pu être identifié.
Le bénéfice en SSP a été observé dans le bras nivolumab en association au cabozantinib vs. sunitinibindépendamment de la catégorie de pronostic IMDC. La médiane de SSP dans le groupe de pronostic favorable n'a pas été atteinte le bras nivolumab en association au cabozantinib, et était de 12,81 mois dans le bras sunitinib (HR = 0,60 ; IC à 95 % : 0,37 à 0,98). La médiane de SSP dans le groupe de pronostic intermédiaire était de 17,71 mois dans le bras nivolumab en association au cabozantinib et était de 8,38 mois dans le bras sunitinib (HR = 0,54 ; IC à 95 % : 0,41 à 0,73). La médiane de SSP dans le groupe de pronostic défavorable était de 12,29 mois dans le bras nivolumab en association au cabozantinib et était de 4,21 mois dans le bras sunitinib (HR = 0,36 ; IC à 95 % : 0,23 à 0,58).
Un bénéfice de la SSP a été observé dans le bras nivolumab en association au cabozantinib vs. sunitinib indépendamment de l'expression tumorale de PD-L1. La médiane de SSP chez les patients avec une expression tumorale de PD-L1 ≥ 1 % était de 13,08 mois dans le bras nivolumab en association au cabozantinib, et était de 4,67 mois dans le bras sunitinib (HR = 0,45 ; IC à 95 % : 0,29 à 0,68). Chez les patients avec une expression tumorale de PD-L1 < 1 %, la médiane de SSP était de 19,84 mois dans le bras nivolumab en association au cabozantinib et était de 9,26 mois dans le bras sunitinib (HR = 0,50 ; IC à 95 % : 0,38 à 0,65).
Des analyses actualisées de la SSP et de la SG ont été réalisées quand tous les patients avaient atteint un suivi minimum de 16,0 mois et une médiane de suivi de 23,5 mois (voir Figures 19 et 20). Le hazard ratio pour la SSP était de 0,52 (IC à 95 % : 0,43 à 0,64). Le hazard ratio de la SG était de 0,66 (IC à 95 % : 0,50 à 0,87). Les données d'efficacité mises à jour (SSP et SG) dans les sous-groupes selon les catégories de pronostic IMDC et selon les niveaux d'expression de PD-L1 confirment les résultats originaux. Dans l'analyse mise à jour, la médiane de SSP est atteinte dans le groupe de pronostic favorable.
Figure 19 : Courbes de Kaplan-Meier pour la SSP (CA2099ER)
Figure 20 : Courbes de Kaplan-Meier de la SG (CA2099ER)
Lymphome de Hodgkin classique
La tolérance et l'efficacité de nivolumab 3 mg/kg en monothérapie dans le traitement du lymphome de Hodgkin classique (LHc) en rechute ou réfractaire après une GCSA (greffe de cellules souches autologue) ont été évaluées dans deux études multicentriques, en ouvert, monobras (CA209205 et CA209039).
L'étude CA209205 est une étude de phase 2, en ouvert, multicohorte, monobras avec nivolumab dans le LHc. Ceci inclut 243 patients qui ont eu une GCSA. La cohorte A a inclus 63 patients (26 %) naïfs de traitement par brentuximabvedotin ; la cohorte B a inclus 80 patients (33 %) ayant reçu un traitement par brentuximabvedotin après échec de GCSA et la cohorte C a inclus 100 patients (41 %) ayant reçu un traitement par brentuximabvedotin avant et/ou après GCSA dont 33 patients (14 %) ayant reçu un traitement par brentuximabvedotin uniquement avant GCSA. Tous les patients ont reçu nivolumab en monothérapie à la dose de 3 mg/kg par voie intraveineuse sur 60 minutes toutes les 2 semaines. Les premières évaluations tumorales ont été effectuées 9 semaines après le début du traitement et poursuivies jusqu'à progression ou arrêt du traitement. Le critère principal d'efficacité était l'ORR évalué par un IRRC. Des critères d'efficacité supplémentaires incluaient la durée de réponse, SSP et survie globale.
L'étude CA209039 est une étude de phase 1b, en ouvert, multicentrique, d'escalade de dose et à doses multiples de nivolumab dans des hémopathies malignes en rechute/réfractaires, incluant 23 patients atteints d'un LHc traités par nivolumab 3 mg/kg en monothérapie ; parmi ceux-ci, 15 patients ont reçu un traitement antérieur par brentuximabvedotin comme traitement de secours après une GCSA, similaires à la cohorte B de l'étude CA209205. Les premières évaluations tumorales ont été réalisées 4 semaines après le début du traitement et poursuivies par la suite jusqu'à progression ou arrêt du traitement. Les évaluations de l'efficacité incluaient l'ORR évalué par l'investigateur, rétrospectivement évalué par un IRRC, et la durée de réponse.
Les données des 80 patients de la cohorte B de l'étude CA209205 et des 15 patients de l'étude CA209039 ayant reçu un traitement antérieur par brentuximab vedotin après une GCSA ont été intégrées. Les données complémentaires de 100 patients de la cohorte C de l'étude CA209205 ayant reçu un traitement par brentuximabvedotin avant et/ou après GCSA sont également présentées. Les caractéristiques à l'inclusion étaient similaires dans les deux études et cohortes (voir le tableau 28 ci-dessous).
Tableau
28 : Caractéristiques des patients à l'inclusion dans la cohorte B, cohorte C
de l'étude CA209205 et l'étude CA209039
| Cohorte B de l'étude CA209205et étude CA209039 (n = 95) | Cohorte Ba de l'étude CA209205 (n = 80) | Etude CA209039 (n = 15) | Cohorte Cb de l'étude CA209205 (n = 100) | |
| Age médian, en année (intervalle) | 37,0 (18-72) | 37,0 (18-72) | 40,0 (24-54) | 32,0 (19-69) |
| Sexe |
61
(64 %) M 34 (36 %) F |
51
(64 %) M 29 (36 %) F |
10
(67 %) M 5 (33 %) F |
56
(56 %) M 44 (44 %) F |
| Statut ECOG | ||||
| 0 | 49 (52 %) | 42 (52,5 %) | 7 (47 %) | 50 (50 %) |
| 1 | 46 (48 %) | 38 (47,5 %) | 8 (53 %) | 50 (50 %) |
| ≥ 5 lignes de traitements systémiques antérieurs | 49 (52 %) | 39 (49 %) | 10 (67 %) | 30 (30 %) |
|
Radiothérapie
antérieure GCSA antérieure |
72 (76 %) | 59 (74 %) | 13 (87 %) | 69 (69 %) |
| 1 | 87 (92 %) | 74 (92,5 %) | 13 (87 %) | 100 (100 %) |
| ≥ 2 | 8 (8 %) | 6 (7,5 %) | 2 (13 %) | 0 (0 %) |
| Médiane en nombre d'années entre la greffe la plus récente et la première dose de traitement à l'étude (min-max) | 3,5 (0,2-19,0) | 3,4 (0,2-19,0) | 5,6 (0,5-15,0) | 1,7 (0,2-17,0 %) |
a18/80 (22,5 %) des patients de la cohorte B de l'étude
CA209205 ont présenté des symptômes B à l'inclusion.
b25/100 (25 %) des patients de la cohorte C de l'étude CA209205 ont présenté des symptômes B à l'inclusion.
b25/100 (25 %) des patients de la cohorte C de l'étude CA209205 ont présenté des symptômes B à l'inclusion.
L'efficacité dans les deux études a été évaluée par le même IRRC. Les résultats sont présentés dans le Tableau 29.
Tableau
29 : Résultats d'efficacité chez les patients atteints de lymphome de Hodgkin
classique en rechute/réfractaire
|
Nombre (n) / Suivi minimum (mois) |
Cohorte
Ba de l'étude CA209205 et étude CA209039 (n = 95/12,0) |
Cohorte
Ba de l'étude CA209205 (n = 80/12,0) |
CA209039
(n = 15/12,0) |
| Réponse objective, n (%) ;(IC à 95 %) | 63 (66 %) ; (56 ; 76) | 54 (68 %) ; (56 ; 78) | 9 (60 %) ; (32 ; 84) |
| Réponse complète (RC), (%) ; (IC à 95 %) | 6 (6 %) ; (2 ; 13) | 6 (8 %) ; (3 ; 16) | 0 (0 %) ; (0 ; 22) |
| Réponse Partielle (RP), (%) ; (IC à 95 %) | 57 (60 %) ; (49 ; 70) | 48 (60 %) ; (48 ; 71) | 9 (60 %) ; (32 ; 84) |
| Maladie stable, n (%) | 22 (23) | 17 (21) | 5 (33) |
|
Durée
de réponse (mois)b
Médiane (IC à 95 %) Intervalle |
13,1 (9,5- NE) 0,0+- 23,1+ |
13,1 (8,7- NE) 0,0+- 14,2+ |
12,0 (1,8- NE) 1,8- 23,1+ |
| Délai médian de réponse Mois (intervalle) | 2,0 (0,7-11,1) | 2,1 (1,6-11,1) | 0,8 (0,7-4,1) |
|
Durée
médiane de suivi
Mois (intervalle) |
15,8 (1,9-27,6) | 15,4 (1,9-18,5) | 21,9 (11,2-27,6) |
| Survie sans progression Taux à 12 mois (IC à 95 %) | 57 (45 ; 68) | 55 (41 ; 66) | 69 (37 ; 88) |
“+”
indique une donnée censurée.
a Le suivi était en cours lors de la soumission des données
b Données incertaines en raison de la durée de réponse limitée pour la cohorte B résultant de la censure.
NE = non estimable
a Le suivi était en cours lors de la soumission des données
b Données incertaines en raison de la durée de réponse limitée pour la cohorte B résultant de la censure.
NE = non estimable
Les données d'efficacité actualisées à partir du suivi à long terme de la cohorte B (minimum 68,7 mois) et de la cohorte C (minimum de 61,9 mois) de l'étude CA209205 sont présentées ci-après dans le Tableau 30.
Tableau 30 : Mise à jour des résultats d'efficacité chez les patients atteints de
lymphome de Hodgkin classique en rechute/réfractaire sur un suivi à long terme
de l'étude CA209205
| Cohorte B de l'étude CA209205 | Cohorte C de l'étude CA209205 | |
| Nombre (n)/ suivi minimum (mois) | (n = 80/68,7) | (n = 100/61,9)a |
| Réponse Objective, n (%);(IC à 95 %) | 57 (71 %) ; (60 ; 81) | 75 (75 %) ; (65 ; 83) |
| Réponse Complète (RC), n (%) ; (IC à 95 %) | 11 (14 %) ; (7 ; 23) | 21 (21 %) ; (14 ; 30) |
| Réponse Partielle (RP), n (%) ; (IC à 95 %) | 46 (58 %) ; (46 ; 69) | 54 (54 %) ; (44 ; 64) |
| Maladie stable, n (%) | 14 (18 %) | 12 (12 %) |
| Durée de réponse chez tous les répondeurs (mois) | ||
| Médiane (IC à 95 %) | 16,6 (9,3 ; 25,7) | 18,2 (11,6 ; 30,9) |
| Intervalle | 0,0+‑71,0+ | (0,0+ ; 55,7+) |
| Durée de réponse en RC (mois) | ||
| Médiane (IC à 95 %) | 30,3 (2,4 ; NE) | 26;4 (7,1 ; NE) |
| Intervalle | 0,7+‑50,0+ | (0,0+ ; 55,7+) |
| Durée de réponse en RP (mois)b | ||
| Médiane (IC à 95 %) | 10,6 (7,5 ; 25,3) | 14,7 (9,4 ; 30,4) |
| Intervalle | 0,0+‑67,9+ | (0,0+ ; 55,9+) |
| Durée médiane de réponse | ||
| Mois (intervalle) | 2,2 (1,6‑11,1) | 2,1 (0,8 ; 17,9) |
| Durée médiane de suivi | ||
| Mois (intervalle) | 58,5 (1,9‑74,3) | 53,5 (1,4 ; 70,4) |
| Survie sans progression | ||
| Médiane (IC à 95 %) | 14,8 (11,0 ; 19,8) | 15,1 (11,1 ; 19,1) |
| Taux à 12 mois (IC à 95 %) | 52 (39 ; 63) | 53 (42 ; 64) |
| Taux à 24 mois (IC à 95 %) | 36 (24 ; 48) | 37 (25 ; 48) |
| Taux à 60 mois (IC à 95 %) | 16 (6 ; 29) | 15 (6 ; 28) |
| Survie globale | ||
| Médiane | Non Atteinte | Non Atteinte |
| Taux à 12 mois (IC à 95 %) | 95 (87 ; 98) | 90 (82 ; 94) |
| Taux à 24 mois (IC à 95 %) | 87 (77 ; 93) | 86 (77 ; 91) |
| Taux à 60 mois (IC à 95 %) | 72 (60 ; 81) | 67 (56 ; 75) |
“+”
indique une donnée censurée.
a Patients de la Cohorte C (n = 33) ayant reçu un traitement par brentuximabvedotin uniquement avant GCSA ont obtenu une ORR de 73 % (IC à 95 % : 55 ; 87), RC de 21 % (IC à 95 % : 9 ; 39), RP de 52 % (IC à 95 % : 34 ;69), durée médiane de réponse était de 13,5 mois (IC à 95 % : 9,4 ; 30,9)
b Déterminé pour les patients avec RC ou RP
NE = non estimable
a Patients de la Cohorte C (n = 33) ayant reçu un traitement par brentuximabvedotin uniquement avant GCSA ont obtenu une ORR de 73 % (IC à 95 % : 55 ; 87), RC de 21 % (IC à 95 % : 9 ; 39), RP de 52 % (IC à 95 % : 34 ;69), durée médiane de réponse était de 13,5 mois (IC à 95 % : 9,4 ; 30,9)
b Déterminé pour les patients avec RC ou RP
NE = non estimable
Les symptômes B étaient présents à l'inclusion chez 22 % (53/243) des patients de l'étude CA209205. Le traitement par nivolumab a provoqué une résolution rapide des symptômes B chez 88,7 % (47/53) des patients avec un délai médian de résolution de 1,9 mois.
Dans une analyse post-hoc des 80 patients de la cohorte B de l'étude CA209205, 37 d'entre eux n'ont pas répondu au traitement antérieur par brentuximab vedotin. Parmi ces 37 patients, le traitement par nivolumab a permis d'atteindre un ORR de 62,5 % (23/37). La durée médiane de réponse était de 25,6 mois (10,6 ; 56,5) pour les 23 répondeurs au nivolumab n'ayant pas atteint de réponse avec le traitement antérieur par brentuximabvedotin.
Cancer épidermoïde de la tête et du cou
La tolérance et l'efficacité du nivolumab 3 mg/kg en monothérapie dans le traitement du SCCHN métastatique ou en rechute ont été évaluées dans une étude de phase 3, randomisée, en ouvert (CA209141). L'étude a inclus des patients (âgés de 18 ans ou plus), présentant un SCCHN en rechute ou métastatique histologiquement confirmé (cavité buccale, pharynx, larynx), de stade III / IV et non éligible à un traitement local à visée curative (chirurgie ou radiothérapie avec ou sans chimiothérapie) et dont la maladie avait progressé pendant le traitement à base de sels de platine ou durant les 6 mois suivant ce traitement et avec un statut de performance ECOG de 0 ou 1. Le traitement antérieur à base de sels de platine a été administré soit en adjuvant, soit en néo-adjuvant, au stade primaire, en rechute ou métastatique. Les patients étaient inclus quel que soit le statut PD-L1 de la tumeur ou le statut d'infection par le papillomavirus humain (HPV). Les patients présentant une maladie auto-immune active, un contexte médical nécessitant une immunosuppression, un carcinome en rechute ou métastatique du nasopharynx ou des glandes salivaires confirmé histologiquement, un carcinome épidermoïde de localisation primitive inconnue ou des lésions dont l'histologie est non épidermoïde (par exemple un mélanome muqueux), ou des métastases cérébrales ou leptoméningées actives ont été exclus de l'étude. Les patients présentant des métastases cérébrales traitées étaient éligibles si leur état neurologique était revenu à l'état initial au moins 2 semaines avant l'inclusion, et que, soit ils ne recevaient plus de corticoïdes, soit ils étaient en phase de stabilisation ou de décroissance de la corticothérapie à une dose de < 10 mg par jour de prednisolone ou équivalents.
Un total de 361 patients a été randomisé pour recevoir soit nivolumab 3 mg/kg (n = 240) administré par voie intraveineuse sur 60 minutes toutes les 2 semaines, soit un traitement selon le choix de l'investigateur : cétuximab (n = 15) à la dose initiale de 400 mg/m2 suivi d'une dose hebdomadaire de 250 mg/m2 ou méthotrexate (n = 52) à une dose hebdomadaire comprise entre 40 et 60 mg/m2 ou docétaxel (n = 54) à une dose hebdomadaire comprise entre 30 et 40 mg/m2. La randomisation a été stratifiée selon un traitement antérieur par cétuximab. Le traitement était poursuivi tant qu'un bénéfice clinique était observé ou jusqu'à ce que le patient ne puisse plus tolérer le traitement. Les évaluations tumorales, selon les critères RECIST version 1.1, ont été réalisées 9 semaines après la randomisation et ont été poursuivies par la suite toutes les 6 semaines. La poursuite du traitement après une progression initiale, évaluée par l'investigateur sur la base des critères RECIST version 1.1, a été autorisée chez les patients recevant nivolumab, si le patient présentait un bénéfice clinique et tolérait le traitement à l'étude, tel que déterminé par l'investigateur. Le critère principal d'efficacité était la SG. Les principaux critères secondaires d'efficacité étaient la PFS et l'ORR évalués par l'investigateur. Des analyses supplémentaires en sous-groupes pré-spécifiées ont été menées pour évaluer l'efficacité selon l'expression tumorale de PD-L1 aux seuils prédéfinis de 1 %, 5 % et 10 %.
Des échantillons de tissu tumoral prélevés avant l'étude ont été systématiquement recueillis avant la randomisation afin d'effectuer des analyses pré-planifiées de l'efficacité selon l'expression tumorale de PD-L1. L'expression tumorale de PD-L1 était déterminée en utilisant le test PD-L1 IHC 28-8 pharmDx.
Les caractéristiques des patients à l'inclusion étaient généralement comparables entre les deux groupes. L'âge médian était de 60 ans (de 28 à 83 ans), dont 31 % ≥ 65 ans et 5 % ≥ 75 ans, 83 % étaient de sexe masculin et 83 % étaient de type caucasien. Le statut de performance ECOG à l'inclusion était de 0 (20 %) ou 1 (78 %), 77 % étaient d'anciens ou d'actuels fumeurs, 90 % présentaient une maladie à un stade IV, 66 % présentaient deux lésions ou plus, 45 %, 34 % et 20 % avaient reçu respectivement 1, 2 ou 3 ou plus lignes de traitements systémiques antérieures, et 25% étaient positifs au HPV-16.
Avec un suivi minimum de 11,4 mois, l'essai a démontré une amélioration statistiquement significative de la SG chez les patients randomisés dans le bras nivolumab par rapport à ceux traités selon le choix de l'investigateur. Les courbes de Kaplan-Meier pour la SG sont présentées sur la Figure 21. Les résultats d'efficacité sont présentés dans le Tableau 31.
Figure 21 : Courbes de Kaplan-Meier pour la SG (CA209141)
Tableau 31 : Résultats d'efficacité (CA209141)
|
nivolumab
(n = 240) |
Choix
de l'investigateur (n = 121) |
|
| Survie globale | ||
| Evénements | 184 (76,7 %) | 105 (86,8 %) |
| Hazard ratioa | 0,71 | |
| (IC à 95 %) | (0,55 ; 0,90) | |
| p-valueb | 0,0048 | |
| Médiane (IC à 95 %) (mois) | 7,72 (5,68 ; 8,77) | 5,06 (4,04 ; 6,24) |
| Taux (IC à 95 %) à 6 mois | 56,5 (49,9 ; 62.5) | 43,0 (34,0 ; 51,7) |
| Taux (IC à 95 %) à 12 mois | 34,0 (28,0 ; 40,1) | 19,7 (13,0 ; 27,3) |
| Taux (IC à 95 %) à 18 mois | 21,5 (16,2 ; 27,4) | 8,3 (3,6 ; 15,7) |
| Survie sans progression | ||
| Evénements | 204 (85,0 %) | 104 (86,0 %) |
| Hazard ratio | 0,87 | |
| IC à 95 % | (0,69 ; 1,11) | |
| p-value | 0,2597 | |
| Médiane (IC à 9 5%) (mois) | 2,04 (1,91 ; 2,14) | 2,33 (1,97 ; 3,12) |
| Taux (IC à 95 %) à 6 mois | 21,0 (15,9 ; 26,6) | 11,1 (5,9 ; 18,3) |
| Taux (IC à 95 %) à 12 mois | 9,5 (6,0 ; 13.9) | 2,5 (0,5 ; 7,8) |
| Réponse objective confirméec | 32 (13,3 %) | 7 (5,8 %) |
| (IC à 95 %) | (9,3 ; 18,3) | (2,4 ; 11,6) |
| Odds ratio (IC 95 %) | 2,49 (1,07 ; 5,82) | |
| Réponse complète (RC) | 6 (2,5 %) | 1 (0,8 %) |
| Réponse partielle (RP) | 26 (10,8 %) | 6 (5,0 %) |
| Maladie stable (MS) | 55 (22,9 %) | 43 (35,5 %) |
| Délai médian de réponse | ||
| Mois (intervalle) | 2,1 (1,8-7,4) | 2,0 (1,9-4,6) |
| Durée médiane de réponse | ||
| Mois (intervalle) | 9,7 (2,8-20,3+) | 4,0 (1,5+-8,5+) |
a Dérivé d'un modèle de risque stratifié
proportionnel.
b La valeur de p est dérivée d'un test stratifié du log-rank par traitement antérieur au cétuximab ; le niveau seuil d'efficacité significatif selon O'Brien-Fleming est de 0,0227.
c Dans le groupe nivolumab, il y avait deux patients avec une réponse complète et sept patients avec une réponse partielle qui présentaient un niveau d'expression tumorale de PD-L1 < 1 %.
b La valeur de p est dérivée d'un test stratifié du log-rank par traitement antérieur au cétuximab ; le niveau seuil d'efficacité significatif selon O'Brien-Fleming est de 0,0227.
c Dans le groupe nivolumab, il y avait deux patients avec une réponse complète et sept patients avec une réponse partielle qui présentaient un niveau d'expression tumorale de PD-L1 < 1 %.
Une expression tumorale quantifiable de PD-L1 a été mesurée chez 67 % des patients dans le groupe nivolumab et 82 % des patients dans le groupe traité selon le choix de l'investigateur. Les niveaux d'expression tumorale de PD-L1 étaient comparables entre les deux groupes de traitement (nivolumabvs traitement selon le choix de l'investigateur) à chaque niveau prédéfini d'expression tumorale de PD-L1, ≥ 1 % (55 % vs 62 %), ≥ 5 % (34 % vs 43 %), ou ≥ 10 % (27 % vs 34 %).
Les patients présentant une expression tumorale de PD-L1 parmi tous les niveaux d'expression prédéfinis ont démontré une plus grande probabilité d'amélioration de la survie globale dans le groupe nivolumab par rapport au groupe de traitement selon le choix de l'investigateur. L'amplitude du bénéfice de la SG était cohérente selon le niveau d'expression tumorale de PD-L1 ≥ 1 %, ≥ 5 % ou ≥ 10 % (voir Tableau 32).
Tableau 32
: SG selon l'expression tumorale de PD-L1 (CA209141)
| Expression de PD-L1 | nivolumab | choix de l'investigateur | |
| SG selon l'expression tumorale de PD-L1 | |||
| Nombre d'événements (nombre de patients) | Hazard ratio non stratifié (IC 95 %) | ||
| < 1 % | 56 (73) | 32 (38) | 0,83 (0,54 ; 1,29) |
| ≥ 1 % | 66 (88) | 55 (61) | 0,53 (0,37 ; 0,77) |
| ≥ 5 % | 39 (54) | 40 (43) | 0,51 (0,32 ; 0,80) |
| ≥ 10 % | 30 (43) | 31 (34) | 0,57 (0,34 ; 0,95) |
Dans une analyse post hoc exploratoire utilisant un test non validé, le niveau d'expression de PD-L1 des cellules tumorales et le niveau d'expression de PD-L1 des cellules immunitaires liées à la tumeur (CILT) ont été analysés au regard de l'amplitude de l'effet du traitement par nivolumab par rapport au traitement selon le choix de l'investigateur. Cette analyse a montré que non seulement le niveau d'expression de PD-L1 des cellules tumorales, mais également le niveau d'expression de PD-L1 des cellules immunitaires liées à la tumeur (CILT), semblaient être associés au bénéfice de nivolumab par rapport au traitement selon le choix de l'investigateur (voir Tableau 33). En raison du faible nombre de patients dans les sous-groupes et du caractère exploratoire de l'analyse, aucune conclusion définitive ne peut être tirée de ces données.
Tableau 33
: Résultats d'efficacité selon le niveau d'expression de PD-L1 des cellules
tumorales et des CILT (CA209141)
| Médiane de SGa (mois) | Médiane de SSPa (mois) | ORR (%) | ||||
| HRb (IC 95 %) | HRb (IC 95 %) | (IC 95 %)c | ||||
| nivolumab | choix de l'investigateur | nivolumab | choix de l'investigateur | nivolumab | choix de l'investigateur | |
|
PD‑L1
≥
1 %, PD‑L1+ CILT abondantesd (61 nivolumab, 47 choix de l'investigateur) |
9,10 | 4,60 | 3,19 | 1,97 | 19,7 | 0 |
| 0,43 (0,28 ; 0,67) | 0,48 (0,31 ; 0,75) | (10,6 ; 31,8) | (0 ; 7,5) | |||
|
PD‑L1
≥
1 %, PD‑L1+ CILT raresd (27 nivolumab, 14 choix de l'investigateur) |
6,67 | 4,93 | 1,99 | 2,04 | 11,1 | 7,1 |
| 0,89 (0,44 ; 1,80) | 0,93 (0,46 ; 1,88) | (2,4 ; 29,2) | (0,2 ; 33,9) | |||
|
PD‑L1 < 1
%, PD‑L1+ CILT abondantesd (43 nivolumab, 25 choix de l'investigateur) |
11,73 | 6,51 | 2,10 | 2,73 | 18,6 | 12,0 |
| 0,67 (0,38 ; 1,18) | 0,96 (0,55 ; 1,67) | (8,4 ; 33,4) | (2,5 ; 31,2) | |||
|
PD-L1 < 1
%, PD‑L1+ CILT raresd (27 nivolumab, 10 choix de l'investigateur) |
3,71 | 4,85 | 1,84 | 2,12 | 3,7 | 10,0 |
| 1,09 (0,50 ; 2,36) | 1,91 (0,84 ; 4,36) | (< 0,1 ; 19,0) | (0,3 ; 44,5) | |||
a La SG et la SSP ont été estimées en utilisant la méthode de
Kaplan-Meier.
b Le Hazard Ratio de chaque sous-groupe est dérivé d'un modèle des risques proportionnels de Cox avec le traitement comme seule covariable.
c L'intervalle de confiance sur l'ORR a été calculé en utilisant la méthode de Clopper-Pearson.
d Les statuts PD‑L1+ CILT du microenvironnement tumoral étaient évalués qualitativement, et caractérisés comme “nombreux”, “intermédiaire”, et “rare” sur la base des évaluations d'anatomopathologistes. Les groupes “nombreux” et “intermédiaire” étaient associés pour définir le groupe “abondant”.
b Le Hazard Ratio de chaque sous-groupe est dérivé d'un modèle des risques proportionnels de Cox avec le traitement comme seule covariable.
c L'intervalle de confiance sur l'ORR a été calculé en utilisant la méthode de Clopper-Pearson.
d Les statuts PD‑L1+ CILT du microenvironnement tumoral étaient évalués qualitativement, et caractérisés comme “nombreux”, “intermédiaire”, et “rare” sur la base des évaluations d'anatomopathologistes. Les groupes “nombreux” et “intermédiaire” étaient associés pour définir le groupe “abondant”.
Les patients dont le site primitif du cancer évalué par l'investigateur était l'oropharynx ont été testés pour le HPV (déterminé par immunohistochimie p16 [IHC]). Le bénéfice en survie globale était observé indépendamment du statut HPV (HPV positif : HR = 0,63 ; IC à 95 % : 0,38 ; 1,04 ; HPV négatif : HR = 0,64 ; IC à 95 % : 0,40 ; 1,03 ; HPV indéterminé : HR = 0,78 ; IC à 95% : 0,55 ; 1,10).
Les résultats rapportés par les patients (RRP) ont été évalués à l'aide de l'échelle EORTC QLQ-C30, EORTC QLQ-H & N35 et EQ-5D à 3 niveaux. Après plus de 15 semaines de suivi, les patients traités par nivolumab ont montré des RRP stables, tandis que ceux issus du bras de traitement selon le choix de l'investigateur ont montré des baisses significatives dans le fonctionnement (par exemple physique, rôle, social) et l'état de santé, ainsi qu'une augmentation de la symptomatologie (par exemple fatigue, dyspnée, perte d'appétit, douleur, problèmes sensoriels, problèmes sociaux). Les données issues des RRP doivent être interprétées avec prudence dans le contexte d'une étude réalisée en ouvert.
Carcinome urothélial
Traitement du carcinome urothélial avancé
Étude de phase 2 en ouvert (CA209275)
La sécurité et
l'efficacité du nivolumab 3 mg/kg en monothérapie
dans le traitement des patients atteints d'un carcinome urothélial
localement avancé ou métastatique ont été évaluées dans une étude de
phase 2, multicentrique, en ouvert et monobras
(CA209275).
L'étude
a inclus des patients (âgés de 18 ans et plus) qui présentaient une
progression de la maladie pendant ou après une chimiothérapie à base de sels de
platine dans le cas d'une maladie à un stade avancé ou métastatique, ou qui
présentaient une progression de la maladie dans les 12 mois suivant le traitement
néoadjuvant ou adjuvant par chimiothérapie à base de
sels de platine. Ces patients présentaient un statut de performance ECOG de
0 ou 1 et ont été inclus indépendamment du statut PD-L1 de leur
tumeur. Les patients présentant des métastases cérébrales ou des métastases leptoméningées actives, une maladie auto-immune active ou
un contexte médical nécessitant une immunosuppression par voie systémique, ont
été exclus de l'étude. Les patients qui avaient reçu plus de 2 lignes de
chimiothérapie antérieures avec des métastases hépatiques ont également été
exclus.
Un total de 270 patients ayant reçu du nivolumab 3 mg/kg par voie intraveineuse pendant 60 minutes toutes les 2 semaines, avec un suivi minimum de 8,3 mois, a pu être évalué en termes d'efficacité. Le traitement était poursuivi tant qu'un bénéfice clinique était observé ou jusqu'à ce que le patient ne puisse plus tolérer le traitement. Les premières évaluations tumorales ont été réalisées 8 semaines après le début du traitement, et se sont ensuite poursuivies toutes les 8 semaines jusqu'à 48 semaines, puis toutes les 12 semaines jusqu'à progression de la maladie ou arrêt du traitement, selon ce qui est survenu le plus tardivement. Les évaluations tumorales ont été poursuivies après l'arrêt du traitement chez les patients qui avaient arrêté le traitement pour des raisons autres que la progression. Le traitement au-delà de la progression initiale évaluée par l'investigateur selon les critères RECIST, version 1.1, était autorisé tant que, selon le jugement de l'investigateur, le patient avait un bénéfice clinique, ne présentait pas de progression rapide de la maladie et tolérait le traitement à l'étude. Le critère principal d'efficacité était l'ORR, déterminé par un BICR. Les autres critères d'évaluation de l'efficacité étaient la durée de réponse, la SSP et la SG.
L'âge médian était de 66 ans (de 38 à 90) ; 55 % des patients étaient âgés de ≥ 65 ans et 14 % étaient âgés de ≥ 75 ans. La majorité des patients était de type caucasien (86 %) et de sexe masculin (78 %). Le statut de performance ECOG à l'inclusion était de 0 (54 %) ou 1 (46 %).
Tableau 34 : Résultats d'efficacité (CA209275)a
| nivolumab (n = 270) | |||
| Réponse objective confirmée | 54 (20,0 %) | ||
| (IC à 95 % ) | (15,4 ; 25,3) | ||
| Réponse complète (RC) | 8 (3,0 %) | ||
| Réponse partielle (PR) | 46 (17,0 %) | ||
| Maladie stable (MS) | 60 (22,2 %) | ||
| Durée médiane de réponseb | |||
| Mois (intervalle) | 10,4 (1,9+-12,0+) | ||
| Délai médian de réponse | |||
| Mois (intervalle) | 1,9 (1,6 ; 7,2) | ||
| Survie sans progression | |||
| Evènements (%) | 216 (80) | ||
| Médiane (IC à 95 %) mois | 2,0 (1,9 ; 2,6) | ||
| Taux (IC 95%) à 6 mois | 26,1 (20,9 ; 31,5) | ||
| Survie globalec | |||
| Evènement (%) | 154 (57) | ||
| Médiane (IC à 95 %) mois | 8,6 (6,05 ; 11,27) | ||
| Taux (IC à 95 %) à 12 mois | 41,0 (34,8 ; 47,1) | ||
| Taux d'expression tumorale de PD-L1 | |||
| < 1 % | ≥ 1 % | ||
|
Réponse
objective confirmée
(IC à 95 %) |
|||
|
16
% (10,3 ; 22,7) n = 146 |
25
% (17,7 ; 33,6) n = 124 |
||
|
Durée
médiane de réponse
Mois (intervalle) |
|||
| 10,4 (3,7 ; 12,0+) | Non atteinte (1,9+ ; 12,0+) | ||
| Survie sans progression | |||
| Médiane (IC à 95 %) mois | 1,9 (1,8 ; 2,0) | 3,6 (1,9 ; 3,7) | |
| Taux (IC à 95 %) à 6 mois | 22,0 (15,6 ; 29,2) | 30,8 (22,7 ; 39,3) | |
| Survie globale | |||
| Médiane (IC à 95 %) mois | 5,9 (4,37 ; 8,08) | 11,6 (9,10 ; NE) | |
| Taux (IC à 95 %) à 12 mois | 34,0 (26,1 ; 42,1) | 49,2 (39,6 ; 58,1) | |
“+”
Indique une donnée censurée.
a Suivi médian de 11,5 mois.
b Données incertaines en raison de la durée de réponse limitée.
c dont 4 décès liés au traitement : 1 pneumopathie inflammatoire, 1 insuffisance respiratoire aiguë, 1 insuffisance respiratoire et 1 insuffisance cardiovasculaire.
NE : non estimable
a Suivi médian de 11,5 mois.
b Données incertaines en raison de la durée de réponse limitée.
c dont 4 décès liés au traitement : 1 pneumopathie inflammatoire, 1 insuffisance respiratoire aiguë, 1 insuffisance respiratoire et 1 insuffisance cardiovasculaire.
NE : non estimable
Les résultats d'analyses post-hoc exploratoires indiquent que chez les patients présentant une expression tumorale de PD-L1 faible (par exemple < 1 %) à nulle, d'autres caractéristiques propres aux patients (par exemple métastases hépatiques, métastases viscérales, taux d'hémoglobine initiale < 10 g/dL et statut de performance ECOG = 1) pourraient contribuer au résultat clinique.
Étude en ouvert de phase 1/2 (CA209032)
L'étude CA209032 était
une étude de phase 1/2 en ouvert, multicohorte,
comprenant une cohorte de 78 patients (dont 18 patients ont reçu un
traitement autorisé en cross over par nivolumab
3 mg/kg et ipilimumab 1 mg/kg en
association) dont les critères d'inclusion étaient similaires à ceux de l'étude
CA209275, traités par nivolumab 3 mg/kg en
monothérapie dans le carcinome urothélial. À un suivi
minimum de 9 mois, l'ORR confirmé, évalué par l'investigateur, était de
24,4 % (IC à 95 % : 15,3 ; 35,4). La durée médiane de
réponse n'a pas été atteinte (4,4 à 16,6+ mois). La SG médiane était
de 9,7 mois (IC à 95 % : 7,26 ; 16,16) et les taux estimés de SG
étaient de 69,2 % (IC : 57,7 ; 78,2) à 6 mois, et de
45,6 % (IC : 34,2 ; 56,3) à 12 mois.
Traitement adjuvant du carcinome urothélial
Etude randomisée de phase 3 avec nivolumab
en adjuvant versus placebo (CA209274)
La
sécurité et l'efficacité du nivolumab en monothérapie
dans le traitement adjuvant du carcinome urothélial
ont été évaluées dans une étude de phase 3 multicentrique, randomisée,
contrôlée versus placebo, en double aveugle (CA209274). L'étude a inclus des
patients (âgés de 18 ans et plus) ayant subi une exérèse complète d'un
carcinome urothélial infiltrant le muscle (CUIM)
originaire de la vessie ou des voies excrétrices supérieures (bassinet ou
uretère) et à haut risque de récidive. Les critères de stadification
pathologique du CUIM définissant un patient à haut risque étaient ypT2- ypT4a
ou ypN+ pour les patients adultes ayant reçu une chimiothérapie
néoadjuvante à base de cisplatine,
et pT3-pT4a ou pN+ pour les patients adultes n'ayant
pas reçu de chimiothérapie néoadjuvante à base de cisplatine et inéligibles à, ou ayant refusé une
chimiothérapie adjuvante à base de cisplatine. Les
patients ont été inclus indépendamment de leur statut tumoral PD-L1, et
présentaient un statut de performance ECOG de 0 ou 1 (un ECOG de 2 était
autorisé pour les patients inéligibles à une chimiothérapie néoadjuvante
à base de cisplatine). L'expression PD-L1 par les
cellules tumorales était déterminée en utilisant le test PD-L1 IHC 28-8 PharmDx. Les patients présentant une maladie auto-immune
active, connue ou suspectée, les patients ayant reçu un traitement par
chimiothérapie, par radiothérapie ou un traitement biologique contre le cancer,
un traitement intravésical, ou un traitement
expérimental dans les 28 jours précédant la première administration du
traitement à l'étude ont été exclus.
Un total de 709 patients a été randomisé pour recevoir soit nivolumab 240 mg (n = 353) toutes les 2 semaines, soit le placebo (n = 356) toutes les 2 semaines jusqu'à récidive ou toxicité inacceptable, pour une durée maximale de traitement de 1 an. Parmi ces patients, 282 présentaient des cellules tumorales exprimant PD-L1 ≥ 1%, 140 dans le bras nivolumab et 142 dans le bras placebo. La randomisation était stratifiée selon le statut anatomopathologique d'atteinte ganglionnaire (N+ versus N0/x avec < 10 ganglions retirés versus N0 avec ≥ 10 ganglions retirés), selon l'expression de PD-L1 par les cellules tumorales (≥ 1 % versus < 1 %/indéterminée), et selon l'utilisation d'une chimiothérapie néoadjuvante à base de cisplatine. Les évaluations tumorales par imagerie devaient être effectuées toutes les 12 semaines à partir de la date de la première dose jusqu'à la semaine 96, puis toutes les 16 semaines de la semaine 96 à la semaine 160, puis toutes les 24 semaines jusqu'à récidive en dehors du tractus urothélial ou jusqu'à arrêt du traitement (selon l'occurrence la plus tardive) durant un maximum de 5 ans. Le critère principal d'efficacité était la survie sans maladie (SSM) chez tous les patients randomisés et la SSM chez les patients randomisés avec une expression tumorale de PD-L1 ≥ 1 %. La SSM était définie comme le temps entre la date de randomisation et la date de première récidive documentée évaluée par l'investigateur (locale au sein du tractus urothélial, locale en dehors du tractus urothélial ou distante) ou le décès (toutes causes), selon la première occurrence. Les critères secondaires d'efficacité incluaient la survie globale (SG).
Les caractéristiques à l'inclusion étaient généralement équilibrées entre les deux groupes. Chez les patients avec des cellules tumorales exprimant PD-L1 ≥ 1 %, l'âge médian était de 66 ans (de 34 à 92 ans) ; 76 % étaient de sexe masculin, et 76 % étaient de type caucasien. Quatre-vingt-deux pour cent avaient une tumeur de la vessie infiltrant le muscle (TVIM), 18 % avaient une tumeur des voies excrétrices supérieures (TVES) (bassinet ou uretère), 42 % des patients ont reçu un traitement antérieur par cisplatine en situation néoadjuvante, 45 % des patients étaient N+ au moment de l'exérèse complète, les patients avaient un statut de performance ECOG de 0 (61 %), 1 (37 %), ou 2 (2 %), et 7 % des patients avaient un taux d'hémoglobine < 10 g/dL.
Lors de la première analyse intermédiaire pré-spécifiée chez les patients avec des cellules tumorales exprimant PD-L1 ≥ 1 % (suivi minimum de 6,3 mois et suivi médian de 22,1 mois pour le bras nivolumab), l'étude a démontré une amélioration statistiquement significative de la SSM pour les patients du bras nivolumab comparé au placebo. La médiane de SSM évaluée par l'investigateur n'a pas été atteinte (IC à 95 % : 21,19 ; N.A), pour nivolumab versus 8,41 mois (IC à 95 % : 5,59 ; 21,19) pour le placebo, HR : 0,55 (IC à 98,72 % : 0,35 ; 0,85), p = 0,0005. L'analyse principale de la SSM a inclus des censures pour nouveau traitement anticancéreux. Les résultats pour la SSM avec et sans censure pour nouveau traitement anticancéreux étaient cohérents.
L'amélioration de la SSM a été confirmée lors d'une analyse descriptive actualisée chez les patients avec des cellules tumorales exprimant PD-L1 ≥ 1 % (suivi minimum de 11,4 mois et suivi médian de 25,5 mois pour le bras nivolumab). Les résultats d'efficacité de cette analyse descriptive actualisée sont décrits dans le Tableau 35 et la Figure 22.
| Tableau 35 : Résultats d'efficacité chez les patients avec des cellules tumorales exprimant PD-L1 ≥ 1% (CA209274) | ||
|
nivolumab
(n = 140) |
placebo
(n = 142) |
|
| Survie Sans Maladie | Suivi minimum de 11,4 mois | |
| Evénements (%) | 56 (40,0) | 85 (59,9) |
| Hazard ratio (IC à 95 %)a | 0,53 (0,38 ; 0,75) | |
| Médiane (IC à 95 %) (mois)b | NA (22,11 ; NE) | 8,41 (5,59 ; 20,04) |
| Taux (IC à 95 %) à 6 mois | 74,5 (66,2 ; 81,1) | 55,7 (46,8 ; 63,6) |
| Taux (IC à 95 %) à 12 mois | 67,6 (59,0 ; 74,9) | 46,3 (37,6 ; 54,5) |
| Taux (IC à 95 %) à 24 mois | 58,6 (49,3 ; 66,9) | 37,4 (29,0 ; 45,8) |
NA : non atteint, NE : non-estimable.
a Modèle de Cox à risque proportionnel stratifié. Le Hazard Ratio est le rapport entre nivolumab et le placebo.
b Basé sur des estimations de Kaplan-Meier.
a Modèle de Cox à risque proportionnel stratifié. Le Hazard Ratio est le rapport entre nivolumab et le placebo.
b Basé sur des estimations de Kaplan-Meier.
Figure 22 : Courbe de Kaplan-Meier de la SSM chez les patients avec des cellules tumorales exprimant PD-L1 ≥ 1 % (CA209274)
Des analyses exploratoires descriptives pré-spécifiées en sous-groupe ont été effectuées chez les patients, sur la base du traitement antérieur par cisplatine en situation néoadjuvante. Dans le sous-groupe de patients dont les cellules tumorales expriment le PD-L1 au seuil de ≥ 1 % ayant reçu un traitement antérieur par cisplatine en situation néoadjuvante (n = 118), le HR de la SSM était de 0,37 (IC à 95 % : 0,22 ; 0,64) avec une médiane de SSM non atteinte pour nivolumab et de 8,41 mois pour le placebo, respectivement. Dans le sous-groupe de patients avec des cellules tumorales exprimant PD-L1 ≥ 1 % n'ayant pas reçu de traitement antérieur par cisplatine en situation néoadjuvante (n = 164), le HR de la SSM était de 0,69 (IC à 95 % : 0,44 ; 1,08) avec une médiane de SSM de 29,67 mois et de 11,37 mois pour nivolumab et pour le placebo, respectivement.
Cancer colorectal dMMR ou MSI-H
La
tolérance et l'efficacité du nivolumab 3 mg/kg en
association à l'ipilimumab 1 mg/kg dans le traitement
du CRC métastatique dMMR ou MSI-H ont été évaluées
dans une étude de phase 2, multicentrique, en ouvert avec un seul bras de
traitement (CA209142). L'étude a inclus des patients (âgés de 18 ans ou plus)
avec un statut dMMR ou MSI-H localement déterminé,
présentant une progression de la maladie pendant ou après un traitement
antérieur associant la fluoropyrimidine et l'oxaliplatine ou l'irinotécan, ou
qui ont été intolérants à ce traitement. Les patients ayant reçu leur
traitement antérieur le plus récent en situation adjuvante devaient avoir
progressé pendant ou dans les 6 mois suivant la fin de la chimiothérapie
adjuvante. Les patients présentaient un statut de performance ECOG de 0 ou 1,
et ont été inclus indépendamment du statut PD-L1 de leur tumeur. Les patients
présentant des métastases cérébrales actives, une maladie autoimmune
active, ou toute maladie nécessitant le recours à une immunosuppression
systémique ont été exclus de l'étude.
Un total de 119 patients a été traité par nivolumab 3
mg/kg administré par voie intraveineuse pendant 60 minutes en association avec
l'ipilimumab 1 mg/kg administré par voie
intraveineuse pendant 90 minutes toutes les 3 semaines pendant 4 doses, suivi
par nivolumab 3 mg/kg en monothérapie toutes les 2
semaines. Le traitement était poursuivi tant qu'un bénéfice clinique était
observé, ou jusqu'à ce que le patient ne puisse plus tolérer le traitement. Les
évaluations tumorales ont été réalisées selon les critères RECIST version 1.1,
toutes les 6 semaines pendant les 24 premières semaines, et toutes les 12
semaines par la suite. Le critère principal était l'ORR évalué par
l'investigateur. Les critères secondaires étaient l'ORR évalué par un comité de
revue indépendant centralisé en aveugle (Blinded
Independent Central Review BICR) et le taux de
contrôle de la maladie. L'analyse de l'ORR incluait la durée et le délai de
réponse. Les critères exploratoires incluaient la SSP et la SG.
L'âge médian était de 58 ans (de 21 à 88 ans) dont 32 % ≥ 65 ans et 9 % ≥
75 ans, 59 % étaient de sexe masculin et 92 % étaient de type caucasien. Le
statut de performance ECOG à l'inclusion était de 0 (45 %) ou 1 (55 %), 25 %
des patients présentaient des mutations BRAF, 37 % des mutations KRAS, et 12 %
avaient un statut inconnu. Parmi les 119 patients traités, 109 ont reçu une
chimiothérapie antérieure à base de fluoropyrimidine
en situation métastatique et 9 en situation adjuvante. Avant leur inclusion
dans l'étude, parmi les 119 patients traités, 118 (99 %) avaient reçu du fluorouracile, 111 (93 %) avaient reçu de l'oxaliplatine, 87 (73 %) avaient reçu de l'irinotécan lors des traitements antérieurs ; 82 (69 %)
avaient reçu un traitement antérieur par fluoropyrimidine,
oxaliplatine et irinotécan.
Vingt-trois pourcent, 36 %, 24 % et 16 % avaient reçu respectivement 1, 2, 3 ou
4 ou plus traitements antérieurs, et 29 % des patients avaient reçu un
traitement par inhibiteur de l'EGFR.
Les résultats d'efficacité (suivi minimum de 46,9 mois, suivi médian de 51,1
mois) sont présentés dans le Tableau 36.
Tableau
36 : Résultats d'efficacité (CA209142)*
|
nivolumab + ipilimumab (n = 119) |
|
| Réponse objective confirmée, n (%) | 77 (64,7) |
| (IC 95 %) | (55,4 ; 73,2) |
| Réponse complète (RC), n (%) | 15 (12,6) |
| Réponse partielle (RP), n (%) | 62 (52,1) |
| Maladie stable (MS), n (%) | 25 (21,0) |
| Durée de réponse | |
| Médiane (intervalle) mois | NA (1,4 ; 58,0+) |
| Délai median de réponse | |
| Mois (intervalle) | 2,8 (1,1 ; 37,1) |
*selon
l'évaluation de l'investigateur
“+” indique une donnée censurée
NA = non atteint
“+” indique une donnée censurée
NA = non atteint
L'ORR
évalué par le BICR était de 61,3 % (IC à 95 % : 52,0 ; 70,1), incluant un taux
de réponse complète de 20,2 % (IC à 95 % : 13,4 ; 28,5), un taux de réponse
partielle de 41,2 % (IC à 95 % : 32,2 ; 50,6) et une maladie stable reportée
dans 22,7 % des cas. Les évaluations du BICR étaient généralement cohérentes
avec celles de l'investigateur. Des réponses confirmées ont été observées
indépendamment du statut de mutation BRAF ou KRAS, et des niveaux d'expression
tumorale de PD-L1.
Parmi les 119 patients, 11 (9,2 %) étaient âgés de ≥ 75 ans. L'ORR évalué
par l'investigateur chez les patients âgés de ≥ 75 ans était de 45,5 %
(IC à 95 % : 16,7 ; 76,6).
Carcinome épidermoïde de l'œsophage
Etude
de phase 3 randomisée avec nivolumab en monothérapie
chez des patients préalablement traités (ONO-4538-24/CA209473)
La tolérance et l'efficacité du nivolumab 240 mg
en monothérapie dans le traitement du carcinome épidermoïde de l'œsophage (CEO)
avancé non résécable, récurrent ou métastatique, ont
été évaluées dans une étude de phase 3 randomisée, contrôlée versus
traitement actif en ouvert (ONO-4538-24/CA209473). L'étude a inclus des
patients adultes (âgés de 20 ans ou plus) réfractaires ou intolérants à au
moins un schéma thérapeutique associant un traitement à base de fluoropyrimidine et de sels de platine, et les patients
étaient inclus indépendamment du niveau d'expression PD-L1 de la tumeur. Les
patients réfractaires ou intolérants à un traitement à base de taxanes, ayant des métastases cérébrales symptomatiques ou
nécessitant un traitement, une maladie auto-immune active, un contexte médical
nécessitant le recours à une immunosuppression par voie systémique, et les
patients avec une invasion tumorale apparente dans les organes situés à
proximité de l'œsophage (par exemple l'aorte ou les voies respiratoires), ont
été exclus de l'étude.
Un total de 419 patients a été randomisé (1:1) pour recevoir soit nivolumab 240 mg administré par voie intraveineuse pendant 30 minutes toutes les 2 semaines (n = 210), soit une chimiothérapie à base de taxanes au choix de l'investigateur : docétaxel 75 mg/m² (n = 65) par voie intraveineuse toutes les 3 semaines, ou paclitaxel 100 mg/m² (n = 144) par voie intraveineuse une fois par semaine pendant 6 semaines suivi d'1 semaine sans traitement. La randomisation était stratifiée selon la localisation géographique (le Japon vs. le reste du monde), le nombre d'organes avec des métastases (≤ 1 vs. ≥ 2) et l'expression tumorale de PD-L1 (≥ 1 % vs. < 1 % ou indéterminé). Le traitement était poursuivi jusqu'à progression de la maladie évaluée par l'investigateur selon les critères RECIST version 1.1, ou toxicité inacceptable. Les évaluations tumorales ont été réalisées toutes les 6 semaines pendant 1 an, puis toutes les 12 semaines par la suite. Le traitement au-delà de la première progression évaluée par l'investigateur était autorisé chez les patients recevant nivolumab sans progression rapide, avec un bénéfice clinique évalué selon l'investigateur, une tolérance au traitement, un statut de performance stable, et pour lesquels un traitement au-delà de la progression ne retarderait pas une intervention imminente pour prévenir des complications graves associées à la progression de la maladie (par exemple des métastases cérébrales). Le critère principal d'efficacité était la SG. Les principaux critères secondaires de mesures des résultats d'efficacité étaient le taux de réponse objective (ORR - TRO) évalué par l'investigateur et la SSP. Des analyses complémentaires en sous -groupe pré-spécifiées ont été conduites afin d'évaluer l'efficacité selon l'expression tumorale de PD-L1 à un seuil prédéfini de 1 %. L'expression tumorale de PD-L1 était déterminée en utilisant le test PD-L1 IHC 28-8 pharmDx.
Les caractéristiques à l'inclusion étaient généralement équilibrées entre les deux groupes. L'âge médian était de 65 ans (de 33 à 87 ans) ; 53 % des patients étaient âgés de ≥ 65 ans, 10 % étaient âgés de ≥ 75 ans, 87 % étaient de sexe masculin, 96 % étaient asiatiques et 4 % étaient de type caucasien. Le statut de performance ECOG à l'inclusion était de 0 (50 %) ou 1 (50 %).
Avec un suivi minimum de 17,6 mois, l'étude a démontré une amélioration statistiquement significative de la SG chez les patients randomisés dans le bras nivolumab, comparé à la chimiothérapie à base de taxanes au choix de l'investigateur. Les résultats d'efficacité sont présentés dans le Tableau 37 et la Figure 23.
Une proportion plus élevée de patients est décédée au cours des 2,5 premiers mois dans le bras nivolumab (32/210 ; 15,2 %), comparé au bras chimiothérapie (15/209 ; 7,2 %). Aucun facteur spécifique associé à ces décès précoces n'a pu être identifié.
Tableau 37 : Résultats d'efficacité (ONO-4538-24/CA209473)
|
nivolumab
(n = 210) |
choix
de l'investigateur (n = 209) |
|
| Survie Globalea | ||
| Evénements | 160 (76 %) | 173 (83 %) |
| Hazard ratio (IC à 95 %)b | 0,77 (0,62 ; 0,96) | |
| p-valuec | 0,0189 | |
| Médiane (IC à 95 %) (mois) | 10,9 (9,2 ; 13,3) | 8,4 (7,2 ; 9,9) |
| Taux de Réponse Objectived,e | 33 (19,3 %) | 34 (21,5 %) |
| (IC à 95 %) | (13,7 ; 26,0) | (15,4 ; 28,8) |
| Réponse Complète | 1 (0,6 %) | 2 (1,3 %) |
| Réponse partielle | 32 (18,7 %) | 32 (20,3 %) |
| Maladie stable | 31 (18,1 %) | 65 (41,1 %) |
| Durée médiane de réponse (IC à 95 %) (mois) | 6,9 (5,4 ; 11,1) | 3,9 (2,8 ; 4,2) |
| Survie Sans Progressiona | ||
| Evénements | 187 (89 %) | 176 (84 %) |
| Médiane (IC à 95 %) (mois) | 1,7 (1,5 ; 2,7) | 3,4 (3,0 ; 4,2) |
| Hazard ratio (IC à 95 %)b | 1,1 (0,9 ; 1,3) | |
a Basé sur une analyse en ITT.
b Basé sur modèle de risques proportionnels stratifiés.
c Basé sur un test de log-rank stratifié.
d Basé sur l'analyse de l'Ensemble des Réponses Evaluables, n = 171
dans le groupe nivolumab et n = 158 dans le groupe au
choix de l'investigateur.
e Non significatif, p-value de 0,6323.
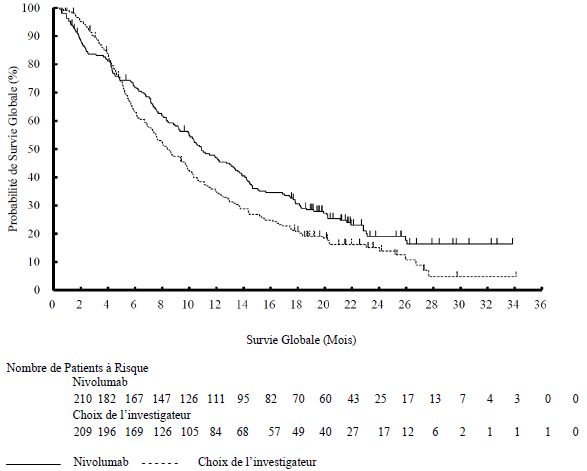
Sur les 419 patients, 48 % présentaient une expression tumorale de PD-L1 ≥ 1 %. Les 52 % de patients restant présentaient une expression tumorale de PD-L1 < 1 %. Dans le sous-groupe de patients avec une tumeur PD-L1 positive, le Hazard Ratio (HR) pour la SG était de 0,69 (IC à 95 % : 0,51 ; 0,94) avec des médianes de survie de respectivement 10,9 et 8,1 mois pour les bras nivolumab et chimiothérapie à base de taxanes au choix de l'investigateur. Dans le sous-groupe de patients atteints d'OSCC avec une tumeur PD-L1 négative, le HR pour la SG était de 0,84 (IC à 95 % : 0,62 ; 1,14) avec des médianes de survie de respectivement 10,9 et 9,3 mois pour les bras nivolumab et chimiothérapie.
Étude de phase 3 randomisée avec nivolumab
en association à l'ipilimumab versus chimiothérapie
et avec nivolumab en association à une chimiothérapie
versus chimiothérapie en première ligne (CA209648)
La tolérance et
l'efficacité du nivolumab en association à l'ipilimumab et de nivolumab en
association à une chimiothérapie ont été évaluées dans une étude randomisée,
contrôlée versus traitement actif, en ouvert (CA209648). L'étude a inclus des
patients adultes (âgés de 18 ans ou plus) atteints d'un CEO avancé non résécable, récurrent ou métastatique, non précédemment
traités. Les patients étaient inclus indépendamment du statut PD-L1 de leur
tumeur, et l'expression de PD-L1 des cellules tumorales était déterminée en
utilisant le test PD-L1 IHC 28-8 pharmDx.
Les patients devaient présenter un carcinome épidermoïde ou un carcinome adénosquameux de l'œsophage, non
éligible à une radiochimiothérapie et/ou une
chirurgie. Un traitement antérieur adjuvant, néoadjuvant,
ou une chimiothérapie définitive, une radiothérapie ou une radiochimiothérapie
étaient permis s'ils avaient été administrés dans le cadre d'un schéma à visée
curative avant l'inclusion dans l'essai. Les patients qui avaient un score de
performance initial ≥ 2, des métastases cérébrales
symptomatiques, une maladie auto-immune active, utilisaient des corticoïdes ou
des immunosuppresseurs systémiques, ou les patients à haut risque de
saignements ou de fistule due à une invasion tumorale apparente dans les organes
adjacents à la tumeur œsophagienne ont été exclus de l'étude. La randomisation
a été stratifiée selon le statut tumoral de PD-L1 (≥ 1 % versus
< 1 % ou indéterminé), selon la région (Asie de l'Est versus le
reste de l'Asie versus le reste du monde), le statut de performance ECOG
(0 versus 1), et le nombre d'organes présentant des métastases (≤ 1
versus ≥ 2).
Un total de 970 patients a été randomisé pour recevoir soit nivolumab en association à l'ipilimumab (n = 325), soit nivolumab en association à une chimiothérapie (n = 321), soit une chimiothérapie (n = 324). Parmi ces patients, 473 présentaient une expression tumorale de PD-L1 ≥ 1 %, 158 dans le bras nivolumab plus ipilimumab, 158 dans le bras nivolumab plus chimiothérapie, et 157 dans le bras chimiothérapie. Les patients du bras nivolumab plus ipilimumab ont reçu nivolumab à la dose de 3 mg/kg toutes les 2 semaines en association à l'ipilimumab à la dose de 1 mg/kg toutes les 6 semaines, et les patients du bras nivolumab plus chimiothérapie ont reçu nivolumab à la dose de 240 mg toutes les 2 semaines aux jours 1 et 15, le fluorouracile à la dose de 800 mg/m2/jour par voie intraveineuse du jour 1 à 5 (pendant 5 jours), et le cisplatine à 80 mg/m2 par voie intraveineuse au jour 1 (d'un cycle de 4 semaines). Les patients du bras chimiothérapie ont reçu le fluorouracile à la dose de 800 mg/m2/jour par voie intraveineuse du jours 1 à 5 (pendant 5 jours), et le cisplatine à 80 mg/m2 par voie intraveineuse au jour 1 (d'un cycle de 4 semaines). Le traitement a été poursuivi jusqu'à progression de la maladie, toxicité inacceptable ou jusqu'à 24 mois. Les patients du bras nivolumab plus ipilimumab, qui ont arrêté le traitement en association en raison d'un effet indésirable attribué à l'ipilimumab ont été autorisés à poursuivre le nivolumab en monothérapie. Pour les patients du bras nivolumab plus chimiothérapie, chez lesquels le fluorouracile et/ou le cisplatine ont été arrêtés, les autres composants du schéma thérapeutique ont pu être poursuivis.
Les caractéristiques à l'inclusion étaient généralement équilibrées entre les groupes de traitement. Parmi les patients avec une expression tumorale de PD-L1 ≥ 1 %, l'âge médian était de 63 ans (de 26 à 85 ans), 8,2 % étaient âgés de ≥ 75 ans, 81,8 % étaient de sexe masculin, 73,1 % étaient asiatiques, et 23,3 % étaient de type caucasien. Les patients avaient une confirmation histologique de carcinome épidermoïde (98,9 %) ou de carcinome adénosquameux (1,1 %) de l'œsophage. Le statut de performance ECOG initial était de 0 (45,2 %) ou 1 (54,8 %).
Nivolumab en association à l'ipilimumab versus chimiothérapie
Les critères primaires d'efficacité étaient la SSP (évaluée par le BICR) et la SG chez les patients présentant une expression tumorale de PD-L1 ≥ 1 %. Les critères d'évaluation secondaires selon les tests hiérarchiques pré-spécifiés comprenaient la SG, la SSP (évaluée par le BICR), et l'ORR (évalué par le BICR) chez tous les patients randomisés. Les évaluations tumorales selon les critères RECIST v1.1 ont été réalisées toutes les 6 semaines jusqu'à la semaine 48 incluse, puis toutes les 12 semaines par la suite.
Lors de l'analyse primaire pré-spécifiée avec un minimum de suivi de 13,1 mois, l'étude a démontré une amélioration statistiquement significative de la SG chez les patients présentant une expression tumorale de PD-L1 ≥ 1 %. Les résultats d'efficacité sont présentés dans le Tableau 38.
| Tableau 38 : Résultats d'efficacité chez les patients présentant une expression tumorale de PD-L1 ≥ 1 % (CA209648) | ||
|
nivolumab + ipilimumab (n = 158) |
chimiothérapiea (n = 157) |
|
| Survie globale | ||
| Évènements | 106 (67,1 %) | 121 (77,1 %) |
| Hazard ratio (IC 98.6 %)b | 0,64 (0,46 ; 0,90) | |
| p-valuec | 0,0010 | |
| Médiane (IC 95 %) (mois)d | 13,70 (11,24 ; 17,02) | 9,07 (7,69 ; 9,95) |
| Taux (IC 95 %) à 12 moisd | 57,1 (49,0 ; 64,4) | 37,1 (29,2 ; 44,9) |
| Survie sans progressione | ||
| Évènements | 123 (77,8 %) | 100 (63,7 %) |
| Hazard ratio (IC 98.5 %)b | 1,02 (0,73 ; 1,43) | |
| p-valuec | 0,8958 | |
| Médiane (IC 95 %) (mois)d | 4,04 (2,40 ; 4,93) | 4,44 (2,89 ; 5,82) |
| Taux (IC 95 %) à 12 moisd | 26,4 (19,5 ; 33,9) | 10,5 (4,7 ; 18,8) |
| Taux de réponse globale, n (%)e | 56 (35,4) | 31 (19,7) |
| (IC 95 %) | (28,0 ; 43,4) | (13,8 ; 26,8) |
| Réponse complète | 28 (17,7) | 8 (5,1) |
| Réponse partielle | 28 (17,7) | 23 (14,6) |
| Durée de réponsee | ||
| Médiane (IC 95 %) (mois)d | 11,83 (7,10 ; 27,43) | 5,68 (4,40 ; 8,67) |
| Intervalle | 1,4+ ; 34,5+ | 1,4+ ; 31,8+ |
a
Fluorouracile et cisplatine.
b Hazard ratio calculé à partir d'un modèle de Cox à risque proportionnel.
c Sur la base d'un test de rang bilatéral stratifié du log-rank.
d Sur la base des estimations de Kaplan-Meier.
e Évalué par le BICR.
b Hazard ratio calculé à partir d'un modèle de Cox à risque proportionnel.
c Sur la base d'un test de rang bilatéral stratifié du log-rank.
d Sur la base des estimations de Kaplan-Meier.
e Évalué par le BICR.
Lors
d'une analyse descriptive actualisée avec un suivi minimum de 20 mois, les
améliorations de la SG étaient cohérentes avec l'analyse primaire. La médiane
de SG était de 13,70 mois (IC à 95 % : 11,24 ; 17,41) pour nivolumab
plus ipilimumab versus 9,07 mois (IC à 95 % : 7,69 ;
10,02) pour la chimiothérapie (HR = 0,63 ; IC à 95 % : 0,49 ; 0,82). La médiane
de la SSP était de 4,04 mois (IC à 95 % : 2,40 ; 4,93) pour nivolumab
plus ipilimumab versus 4,44 mois (IC à 95 % : 2,89 ;
5,82) pour la chimiothérapie (HR = 1,02 ; IC à 95 % : 0,77 ; 1,34). L'ORR était
de 35,4 % (IC à 95 % : 28,0 ; 43,4) pour nivolumab
plus ipilimumab versus 19,7 % (IC à 95 % : 13,8 ;
26,8) pour la chimiothérapie.
Les courbes de Kaplan-Meier pour la SG avec un suivi minimum de 20 mois sont
présentées dans la Figure 24.
Figure 24 : Courbes de Kaplan-Meier pour la SG chez les patients présentant une expression
tumorale de PD-L1 ≥ 1 % (CA209648)
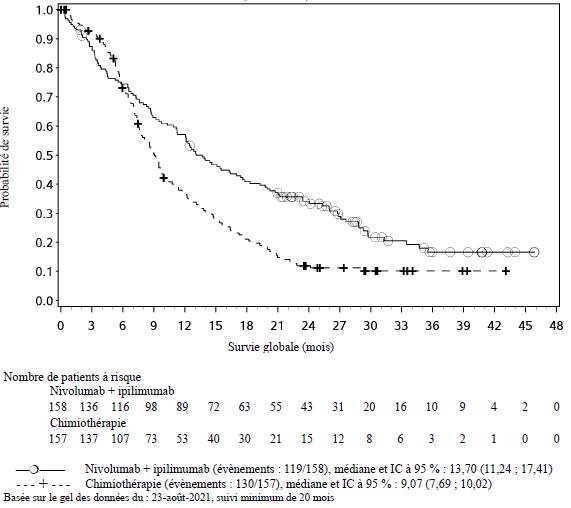

Nivolumab en association à une chimiothérapie versus chimiothérapie
Les critères primaires d'efficacité étaient la SSP (évaluée par le BICR) et la SG chez les patients présentant une expression tumorale de PD-L1 ≥ 1 %. Les critères d'évaluation secondaires selon les tests hiérarchiques pré-spécifiés comprenaient la SG, la SSP (évaluée par le BICR), et l'ORR (évalué par le BICR) chez tous les patients randomisés. Les évaluations tumorales selon les critères RECIST v1.1 ont été réalisées toutes les 6 semaines jusqu'à la semaine 48 incluse, puis toutes les 12 semaines par la suite.
Lors de l'analyse primaire prés-spécifiée, avec un minimum de suivi de 12,9 mois, l'étude a démontré une amélioration statistiquement significative de la SG et de la SSP chez les patients présentant une expression tumorale de PD-L1 ≥ 1 %. Les résultats d'efficacité sont présentés dans le Tableau 39.
| Tableau 39 : Résultats d'efficacité chez les patients présentant une expression tumorale de PD-L1 ≥ 1 % (CA209648) | ||
|
nivolumab + chimiothérapie (n = 158) |
chimiothérapiea (n = 157) |
|
| Survie globalel | ||
| Évènements | 98 (62,0 %) | 121 (77,1 %) |
| Hazard ratio (IC à 99,5 %)b | 0,54 (0,37 ; 0,80) | |
| p-valuec | <0,0001 | |
| Médiane (IC à 95 %) (mois)d | 15,44 (11,93 ; 19,52) | 9,07 (7,69 ; 9,95) |
| Taux (IC à 95 %) à 12 moisd | 58,0 (49,8 ; 65,3) | 37,1 (29,2 ; 44,9) |
| Survie sans progressione | ||
| Évènements | 117 (74,1 %) | 100 (63,7 %) |
| Hazard ratio (IC à 98.5 %)b | 0,65 (0,46 ; 0,92) | |
| p-valuec | 0,0023 | |
| Médiane (IC à 95 %) (mois)d | 6,93 (5,68 ; 8,34) | 4,44 (2,89 ; 5,82) |
| Taux (IC à 95 %) à 12 moisd | 25,4 (18,2 ; 33,2) | 10,5 (4,7 ; 18,8) |
| Taux de réponse global, n (%)e | 84 (53,2) | 31 (19,7) |
| (IC à 95 %) | (45,1 ; 61,1) | (13,8 ; 26,8) |
| Réponse complète | 26 (16,5) | 8 (5,1) |
| Réponse partielle | 58 (36,7) | 23 (14,6) |
| Durée de réponsee | ||
| Médiane (IC à 95 %) (mois)d | 8,38 (6,90 ; 12,35) | 5,68 (4,40 ; 8,67) |
| Intervalle | 1,4+, 34,6 | 1,4+, 31,8+ |
a Fluorouracile et cisplatine.
b Hazard ratio calculé à partir d'un modèle de Cox à risque proportionnel.
c Sur la base d'un test de rang bilatéral stratifié du log-rank.
d Sur la base des estimations de Kaplan-Meier.
e Évalué par le BICR
b Hazard ratio calculé à partir d'un modèle de Cox à risque proportionnel.
c Sur la base d'un test de rang bilatéral stratifié du log-rank.
d Sur la base des estimations de Kaplan-Meier.
e Évalué par le BICR
Lors
d'une analyse descriptive actualisée avec un suivi minimum de 20 mois, les
améliorations de la SG étaient cohérentes avec l'analyse primaire. La médiane
de SG était de 15,05 mois (IC à 95 % : 11,93 ; 18,63) pour nivolumab
plus chimiothérapie versus 9,07 mois (IC à 95 % : 7,69 ; 10,02) pour la
chimiothérapie (HR = 0,59 ; IC à 95 % : 0,46 ; 0,76). La médiane de la SSP
était de 6,93 mois (IC à 95 % : 5,68 ; 8,35) pour nivolumab
plus chimiothérapie versus 4,44 mois (IC à 95 % : 2,89 ; 5,82) pour la
chimiothérapie (HR = 0,66 ; IC à 95 % : 0,50 ; 0,87). L'ORR était de 53,2 % (IC
à 95 % : 45,1 ; 61,1) pour nivolumab plus
chimiothérapie versus 19,7 % (IC à 95 % : 13,8 ; 26,8) pour la chimiothérapie.
Les courbes de Kaplan-Meier pour la SG et la SSP avec un suivi minimum de
20 mois sont présentées dans les Figures 25 et 26.
Figure 25 : Courbes de Kaplan-Meier pour la SG chez les patients présentant une expression tumorale de PD-L1 ≥ 1 % (CA209648)
Figure 26 : Courbes de Kaplan-Meier pour la SSP chez les patients présentant une expression tumorale de PD-L1 ≥ 1 % (CA209648)
Traitement adjuvant du cancer de l'œsophage ou de la
jonction œso-gastrique
La tolérance et l'efficacité du nivolumab en monothérapie dans le traitement adjuvant du cancer de l'œsophage ou de la jonction œso-gastrique ont été évaluées dans une étude de phase 3 multicentrique, randomisée, contrôlée versus placebo, en double aveugle (CA209577). L'étude a inclus des patients adultes qui ont reçu une RCT, suivie par une résection chirurgicale complète du carcinome dans les 16 semaines précédant la randomisation, et qui présentaient une maladie résiduelle, confirmée par l'investigateur, avec au moins un stade ypN1 ou ypT1. Les patients ayant un score de performance initial ≥ 2, n'ayant pas reçu de RCT concomitante avant la chirurgie, avec une tumeur résécable de stade IV, une maladie auto-immune active ou un contexte médical nécessitant une immunosuppression par voie systémique ont été exclus de l'étude. Les patients ont été inclus indépendamment du niveau d'expression tumorale de PD-L1.
Un total de 794 patients a été randomisé 2 : 1 pour recevoir soit nivolumab 240 mg (n = 532) soit le placebo (n = 262). Les patients ont reçu nivolumab par voie intraveineuse pendant 30 minutes toutes les 2 semaines durant 16 semaines, suivi de 480 mg perfusés pendant 30 minutes toutes les 4 semaines à partir de la semaine 17. Les patients ont reçu le placebo par voie intraveineuse pendant 30 minutes avec le même schéma d'administration que nivolumab. La randomisation a été stratifiée selon le statut tumoral de PD-L1 (≥1 % vs. <1 % ou indéterminé ou non évaluable), le statut pathologique des ganglions lymphatiques (positif ≥ ypN1 vs. négatif ypN0) et l'histologie de la tumeur (épidermoïde vs. adénocarcinome). Le traitement était poursuivi jusqu'à récidive de la maladie, toxicité inaccepable ou pour une durée totale maximale d'1 an. Le critère d'évaluation principal était la survie sans maladie (SSM) évaluée par l'investigateur, définie comme le temps entre la date de randomisation et la date de première récidive (locale, régionale, ou à distance du site primaire réséqué) ou le décès quelle que soit la cause, selon le premier événement. Les patients sous traitement étaient évalués par imagerie pour la récidive de la tumeur toutes les 12 semaines pendant 2 ans, et au minimum par un scanner tous les 6 à 12 mois entre la 3e à la 5e année.
Les caractéristiques à l'inclusion étaient généralement équilibrées entre les deux groupes. L'âge médian était de 62 ans (de 26 à 86 ans) avec 36 % ≥ 65 ans et 5 % ≥ 75 ans. La majorité des patients étaient de type caucasien (82 %) et étaient de sexe masculin (85 %). Le statut de performance ECOG à l'inclusion était de 0 (58 %) ou 1 (42 %).
Lors de l'analyse intermédiaire primaire pré-définie du critère principal (suivi minimum de 6,2 mois et une médiane de suivi de 24,4 mois) l'étude a montré une amélioration statistiquement significative de la SSM chez les patients du bras nivolumab comparé au placebo. La SSM médiane déterminée par l'investigateur était de 22,41 mois (IC à 95 % : 16,62 ; 34,00) pour nivolumab versus 11,04 mois (IC à 95 % : 8, 34 ; 14,32) pour le placebo, avec un HR de 0,69 (IC à 96,4 % : 0, 56 ; 0,86), et une p-value < 0,0003. L'analyse principale de la SSM a inclus des censures pour un nouveau traitement anti-cancéreux. Les résultats de la SSM avec ou sans censure pour le nouveau traitement anti-cancéreux étaient cohérents. Dans une analyse descriptive actualisée de la SSM avec un suivi minimum de 14 mois et une médiane de suivi de 32,2 mois, l'amélioration de la SSM a été confirmée. Les résultats d'efficacité de cette analyse secondaire descriptive sont présentés dans le Tableau 40 et sur la Figure 27.
| Tableau 40 : Résultats d'efficacité (CA209577) | ||
| nivolumab (n = 532) |
placebo (n = 262) |
|
|
Survie
Sans Maladiea
avec
un suivi minimum de 14 moisc
|
||
| Évènements (%) | 268 (50) | 171(65) |
| Hazard ratio (IC à 95 %)b | 0,67 (0,55 ; 0,81) | |
| Médiane (IC à 95 %) (mois) | 22,4 (17,0 ; 33,6) | 10,4 (8,3 ; 13,9) |
| Taux à 6 mois (IC à 95 %) | 72,6 (68,5 ; 76, 3) | 61,5 (55,3 ; 67,1) |
| Taux à 12 mois (IC à 95 %) | 61,8 (57,4 ; 65,8) | 45,5 (39,3 ; 51,4) |
| Taux à 24 mois (IC à 95 %) | 48,3 (43,7 ; 52,8) | 36,0 (29,9 ; 42,0) |
a
Basée sur tous les patients randomisés.
b Hazard ratio calculé à partir d'un modèle de Cox à risque proportionnel.
c Analyse descriptive basée sur le gel des données du 18 Février 2021
Figure 27 : Courbes de Kaplan-Meier pour la SSM (CA209577)
b Hazard ratio calculé à partir d'un modèle de Cox à risque proportionnel.
c Analyse descriptive basée sur le gel des données du 18 Février 2021
Figure 27 : Courbes de Kaplan-Meier pour la SSM (CA209577)
Le bénéfice en SSM a été observé indépendamment de l'histologie et de l'expression PD-L1 de la tumeur.
Adénocarcinome gastrique, de la jonction œso-gastrique ou de l'œsophage
La tolérance et l'efficacité du nivolumab 240 mg toutes les 2 semaines ou 360 mg toutes les 3 semaines en association à une chimiothérapie (la dose et le schéma d'administration de nivolumab a été choisie en fonction du schéma de traitement de la chimiothérapie, voir ci-dessous) ont été évaluées dans une étude de phase 3, randomisée, en ouvert (CA209649). L'étude a inclus des patients adultes (âgés de 18 ans ou plus), atteints d'adénocarcinome gastrique, de la jonction œso-gastrique (JOG) ou de l'œsophage de stade avancé ou métastatique, non précédemment traités, n'ayant reçu aucun traitement systémique (incluant les inhibiteurs d'HER2), et ayant un statut de performance ECOG de 0 ou 1. Les patients ont été inclus indépendamment du niveau d'expression de PD-L1 des cellules tumorales, et l'expression de PD-L1 des cellules tumorales était déterminée par le test PD-L1 IHC 28-8 pharmDx. Une réévaluation rétrospective du statut PD-L1 de la tumeur des patients utilisant le CPS a été réalisée à partir des échantillons tumoraux PD-L1 marqués utilisés lors de la randomisation. Les patients ayant des antécédents de tumeurs HER2-positives, qui avaient un score de performance ECOG initial ≥ 2, des métastases du système nerveux central non traitées, ou qui présentaient une maladie auto-immune active, connue ou suspectée, ou un contexte médical nécessitant une immunosuppression par voie systémique ont été exclus de l'étude. Un total de 643 patients avec un statut HER2 indéterminé (40,3% de la population de l'étude) a été inclus dans l'étude. La randomisation a été stratifiée selon le statut tumoral de PD-L1 (≥ 1 % vs. < 1 % ou indéterminé), selon la région (Asie versus États-Unis versus le reste du monde), le statut de performance ECOG (0 versus 1), et le schéma de traitement par chimiothérapie. La chimiothérapie était composée de FOLFOX (fluorouracile, leucovorine et oxaliplatine) ou de CapeOX (capécitabine et oxaliplatine).
Un total de 1 581 patients a été randomisé pour recevoir soit nivolumab en association à une chimiothérapie soit une chimiothérapie. Parmi ces patients, 955 présentaient un CPS-PD-L1 ≥ 5 ; 473 dans le bras nivolumab plus chimiothérapie et 482 dans le bras chimiothérapie. Les patients du bras nivolumab plus chimiothérapie ont reçu soit nivolumab 240 mg par perfusion intraveineuse pendant 30 minutes en association avec FOLFOX (oxaliplatine 85 mg/m², leucovorine 400 mg/m² et fluorouracile 400 mg/m² par voie intraveineuse au jour 1, et fluorouracile 1 200 mg/m² par perfusion intraveineuse continue pendant 24 heures ou selon le standard local au jour 1 et 2) toutes les 2 semaines, ou nivolumab 360 mg par perfusion intraveineuse pendant 30 minutes en association à CapeOX (oxaliplatine 130 mg/m² par voie intraveineuse au jour 1 et capécitabine 1 000 mg/m² par voie orale deux fois par jour, tous les jours, du jour 1 au 14ème jour) toutes les 3 semaines. Le traitement a été poursuivi jusqu'à progression de la maladie, toxicité inacceptable, ou jusqu'à 24 mois pour nivolumab seulement. Chez les patients ayant reçu nivolumab plus une chimiothérapie et chez lesquels la chimiothérapie a été interrompue, nivolumab pouvait être poursuivi en monothérapie à la posologie de 240 mg toutes les 2 semaines, 360 mg toutes les 3 semaines ou 480 mg toutes les 4 semaines jusqu'à 24 mois après l'initiation du traitement. Des évaluations tumorales ont été effectuées toutes les 6 semaines jusqu'à la semaine 48 incluse, puis toutes les 12 semaines par la suite.
Les caractéristiques à l'inclusion étaient généralement équilibrées entre les groupes de traitement. Parmi les patients présentant un CPS-PD-L1 ≥ 5, l'âge médian était de 62 ans (18-90), 11 % étaient âgés de ≥ 75 ans, 71 % étaient de sexe masculin, 25 % étaient d'origine asiatique et 69 % de type caucasien. Le statut de performance ECOG initial était de 0 (42 %) ou 1 (58 %). Les localisations tumorales étaient au niveau gastrique (70 %), de la jonction œso-gastrique (18 %), et de l'œsophage (12 %).
Les critères primaires d'efficacité étaient la SSP (évaluée par le BICR) et la SG évaluée chez les patients avec un CPS-PD-L1 ≥ 5 basé sur le test PD-L1 IHC 28-8 pharmDX. Les critères d'évaluation secondaires selon les tests hiérarchiques pré-spécifiés étaient la SG, chez les patients avec un CPS-PD-L1 ≥ 1 et chez tous les patients randomisés ; les autres critères d'évaluation incluaient l'ORR (BICR) chez les patients CPS PD-L1 ≥ 5 et chez tous les patients randomisés. Lors de l'analyse primaire pré-spécifiée, avec un suivi minimum de 12,1 mois, l'étude a démontré une amélioration statistiquement significative de la SG et de la SSP chez les patients avec un CPS-PD-L1 ≥ 5. La SG médiane était de 14,4 mois (IC à 95 % : 13,1 ; 16,2) pour nivolumab en association à une chimiothérapie versus 11,1 mois (IC à 95 % : 10,0 ; 12,1) pour la chimiothérapie (HR = 0,71 ; IC à 98,4 % : 0,59 ; 0,86 ; p-value < 0,0001). La SSP médiane était de 7,69 mois (IC à 95% : 7,03 ; 9,17) pour nivolumab en association à une chimiothérapie versus 6,05 mois (IC à 95 % : 5,55 ; 6,90) pour la chimiothérapie (HR = 0,68 ; IC à 98 % : 0,56 ; 0,81 ; p-value < 0,0001). L'ORR était de 60% (IC à 95 % : 55 ; 65) pour nivolumab en association à une chimiothérapie versus 45 % (IC à 95 % : 40 ; 50) pour la chimiothérapie.
Lors d'une analyse descriptive actualisée avec un suivi minimum de 19,4 mois, l'amélioration de la SG était cohérente avec l'analyse primaire. Les résultats d'efficacité sont présentés dans le Tableau 41, et les Figures 28 et 29.
| Tableau 41 : Résultats d'efficacité pour la SG chez les patients PD-L1 avec un CPS ≥ 5 (CA209649) | ||
|
nivolumab + chimiothérapie (n = 473) |
chimiothérapie
(n = 482) |
|
|
Suivi
minimum 19,4 moisa
|
||
| Survie globale | ||
| Evénements | 344 (73 %) | 397 (82 %) |
| Hazard ratio (IC à 95 %)b | 0,69 (0,60 ; 0,81) | |
|
Médiane (IC à 95 %) (mois)c Taux (IC à 95 %) à 12 mois |
14,4
(13,1 ; 16,3) 57,3 (52,6 ; 61,6) |
11,1
(10,0 ; 12,1) 46,4 (41,8 ; 50,8) |
| Survie sans progressiond | ||
| Evénements | 342 (72,3 %) | 366 (75,9 %) |
| Hazard ratio (IC à 95 %)b | 0,68 (0,59 ; 0,79) | |
|
Médiane (IC à 95 %) (mois)c Taux (IC à 95 %) à 12 mois |
8,31
(7,03 ; 9,26) 36,3 (31,7 ; 41,0) |
6,05
(5,55 ; 6,90) 21,9 (17,8 ; 26,1) |
| Taux de réponse objective, nd,e | 227/378 (60 %) | 176/390 (45 %) |
| (IC à 95 %) | (54,9 ; 65,0) | (40,1 ; 50,2) |
| Réponse complète | 12,2 % | 6,7 % |
| Réponse partielle | 47,9 % | 38,5 % |
| Durée de réponsed,e | ||
| Médiane (IC à 95 %) (mois)c | 9,69 (8,25 ; 12,22) | 6,97 (5,62 ; 7,85) |
a Analyse descriptive basée sur le gel des données
du : 04-janvier-2021.
b Hazard ratio calculé à partir d'un modèle de Cox à risque proportionnel.
c Estimation de Kaplan-Meier.
d Confirmé par le BICR.
e Basé sur les patients ayant une maladie mesurable à l'inclusion.
b Hazard ratio calculé à partir d'un modèle de Cox à risque proportionnel.
c Estimation de Kaplan-Meier.
d Confirmé par le BICR.
e Basé sur les patients ayant une maladie mesurable à l'inclusion.
Figure 28 : Courbes de Kaplan-Meier pour la SG chez les patients PD-L1 avec un CPS ≥ 5 (CA209649)
Figure 29 : Courbes de Kaplan-Meier pour la SSP chez les patients PD-L1 avec un CPS ≥ 5 (CA209649)
Population pédiatrique
Étude en ouvert de phase 1/2 (CA209070)
L'étude CA209070 était une étude en ouvert de phase 1/2, monobras,
pour confirmation de la dose et extension de la dose, évaluant le nivolumab en monothérapie et en association avec l'ipilimumab chez des patients pédiatriques et de jeunes
adultes présentant des tumeurs hématologiques ou solides récidivantes ou
réfractaires, incluant le neuroblastome,
l'ostéosarcome, le rhabdomyosarcome, le sarcome
d'Ewing, le mélanome avancé, le LHc et le lymphome
non hodgkinien (LNH). Parmi les 126 patients traités, 97 étaient des patients
pédiatriques âgés de 12 mois à < 18 ans. Parmi ces 97 patients pédiatriques,
64 ont été traités par nivolumab en monothérapie (3
mg/kg administré par voie intraveineuse pendant 60 minutes toutes les 2
semaines) et 33 ont été traités par nivolumab en
association avec l'ipilimumab (nivolumab
1 mg/kg ou 3 mg/kg administré par voie intraveineuse pendant 60 minutes en association
avec l'ipilimumab 1 mg/kg administré par voie
intraveineuse pendant 90 minutes toutes les 3 semaines pour les 4 premières
doses, suivi par nivolumab 3 mg/kg en monothérapie
toutes les 2 semaines). Les patients ont reçu soit nivolumab
en monothérapie avec une médiane de 2 doses (intervalle : 1 ; 89) soit nivolumab en association avec ipilimumab
avec une médiane de 2 doses (intervalle : 1 ; 24). Les critères d'évaluation
principaux étaient la sécurité, la tolérance et l'activité antitumorale
évaluée par l'analyse descriptive de l'ORR et de la SG.
Parmi les 64 patients pédiatriques traités par nivolumab en monothérapie, la réponse était évaluable chez 60 d'entre eux (mélanome n = 1, tumeurs solides n = 47 et tumeurs hématologiques n = 12). Chez les 48 patients pédiatriques présentant un mélanome ou des tumeurs solides pour lesquels la réponse était évaluable, aucune réponse objective n'a été observée. Chez les 12 patients pédiatriques présentant des tumeurs hématologiques pour lesquels la réponse était évaluable, l'ORR était de 25,0 % (IC à 95 % : 5,5 ; 57,2), incluant 1 réponse complète pour un cas de LHc et 2 réponses partielles, une pour un cas de LHc et une autre pour un cas de LNH. Dans les analyses descriptives pour les 64 patients pédiatriques traités par nivolumab en monothérapie, la SG médiane était de 6,67 mois (IC à 95 % : 5,98 ; N.A.) et 6,14 mois (IC à 95 % : 5,39 ; 24,67) pour les patients présentant un mélanome ou des tumeurs solides, et elle n'a pas été atteinte pour les patients présentant des tumeurs hématologiques.
Parmi les 30 patients pédiatriques traités par nivolumab en association avec l'ipilimumab (tumeurs solides autres que mélanome uniquement) pour lesquels la réponse était évaluable, aucune réponse objective n'a été observée. Chez les 33 patients pédiatriques traités par nivolumab en association avec l'ipilimumab, la SG médiane était de 8,25 mois (IC à 95 % : 5,45 ; 16,95) d'après une analyse descriptive.
Étude en ouvert de phase 1b/2 (CA209908)
L'étude CA209908 était une étude en ouvert, à bras séquentiel, de phase 1b/2
évaluant nivolumab en monothérapie et nivolumab en association à l'ipilimumab
chez les patients pédiatriques et les jeunes adultes présentant des tumeurs
primitives du SNC de haut grade, incluant le gliome pontique intrinsèque diffus
(GPID), le gliome de haut grade, le médulloblastome, l'épendymome
et autres sous-types récurrents de tumeurs du SNC de haut grade (par exemple : pinéoblastome, tumeur tératoïde/rhabdoïde atypique, et tumeurs embryonnaires du SNC). Parmi
les 151 patients pédiatriques (âgés de ≥ 6 mois à < 18 ans) inclus
dans l'étude, 77 ont été traités par nivolumab en
monothérapie (3 mg/kg toutes les 2 semaines) et 74 ont été traités par nivolumab en association à l'ipilimumab
(3 mg/kg de nivolumab suivi de 1 mg/kg d'ipilimumab, toutes les 3 semaines pour 4 doses, suivi de nivolumab en monothérapie 3 mg/kg toutes les 2 semaines).
Les critères principaux d'efficacité étaient la SG pour la cohorte GPID et la
SSP évaluée par l'investigateur, basée sur les critères RANO, pour tous les
autres types de tumeur. La médiane de SG dans la cohorte GIPD était de 10,97
mois (IC à 80 % : 9,92 ; 12,16) chez les patients traités par nivolumab en monothérapie et 10,50 mois (IC à 80 % : 9,10 ;
12,32) chez les patients traités par nivolumab en
association à l'ipilimumab. Pour tous les autres
types de tumeur pédiatrique du SNC étudiés, la médiane de SSP allait de 1,23 à
2,35 mois chez les patients traités par nivolumab en
monothérapie et de 1,45 à 3,09 mois chez les patients traités par nivolumab en association à l'ipilimumab.
Il n'y a pas eu de réponse objective observée dans l'étude, à l'exception d'un
patient atteint d'épendymome traité par nivolumab en monothérapie qui a présenté une réponse
partielle. Les résultats de SG, SSP, et de taux de réponse objective observés
dans l'étude CA209908 ne suggèrent pas de bénéfice clinique significatif par
rapport à celui pouvant être attendu dans ces populations de patients.
L'Agence européenne des médicaments a différé l'obligation de soumettre les résultats d'études réalisées avec nivolumab dans tous les sous-groupes de la population pédiatrique dans le traitement des néoplasmes malins des tissus lymphoïdes (voir rubrique Posologie et mode d'administration pour les informations concernant l'usage pédiatrique).
Tolérance et efficacité chez les patients âgés
Aucune différence globale de tolérance ou d'efficacité n'a été rapportée entre
les patients âgés ≥ 65 ans) et les patients plus jeunes (< 65 ans).
Les données chez les patients âgés de 75 ans ou plus dans le SCCHN, le mélanome
adjuvant et le CO ou le CJOG adjuvant sont trop limitées pour tirer des
conclusions sur cette population. Les données chez les patients âgés de 65 ans
ou plus dans le LHc sont trop limitées pour tirer des
conclusions dans cette population. Les données provenant des patients atteints
de MPM ont montré un taux plus élevé d'effets indésirables graves et d'arrêt dû
à des effets indésirables chez les patients de 75 ans ou plus (68 % et 35 %
respectivement) comparé à tous les patients ayant reçu du nivolumab
en association à l'ipilimumab (54 % et 28 %
respectivement).
Nivolumab en monothérapie
La pharmacocinétique de nivolumab est linéaire pour des posologies
allant de 0,1 à 10 mg/kg. La moyenne géométrique de la clairance (CL),
la demi-vie terminale, et l'exposition moyenne à l'état d'équilibre à
la dose de 3 mg/kg de nivolumab toutes les 2 semaines étaient
respectivement de7,9 mL/h, 25,0 jours, et 86,6 µg/mL, sur la base d'analyses de pharmacocinétique de population.
La CL du nivolumab chez des patients atteints de LHc était environ 32 % plus faible que chez des patients atteints de CBNPC. La CL de référence du nivolumab chez des patients atteints d'un mélanome adjuvant était environ 40 % plus faible et la CL à l'état d'équilibre était environ 20 % plus faible que chez des patients atteints de mélanome avancé. Avec les données de tolérance disponibles, ces diminutions de la CL n'étaient pas cliniquement significatives.
La voie métabolique de nivolumab n'a pas été caractérisée. Il est attendu que nivolumab soit dégradé en petits peptides et acides aminés via des voies cataboliques au même titre que les IgG endogènes.
Nivolumab en association à l'ipilimumab
Lorsque nivolumab 1 mg/kg était administré en association à ipilimumab
3 mg/kg, la clairance de nivolumab a augmenté de 29 % et la clairance
d'ipilimumab a été augmentée de 9 %, ce qui n'a pas été considéré comme
cliniquement pertinent. Lorsque nivolumab 3 mg/kg était administré en
association à ipilimumab 1 mg/kg, la clairance de nivolumab a augmenté
de 1 %, et la clairance de l'ipilimumab a été diminuée de 1,5 %, ces
changements n'étant pas considérés comme cliniquement pertinents.
Lorsqu'il est administré en association avec l'ipilimumab, la clairance de nivolumab est augmentée de 20 % en présence d'anticorps anti-nivolumab et la clairance de l'ipilimumab est augmentée de 5,7 % en présence d'anticorps anti-ipilimumab. Ces changements n'ont pas été considérés comme étant cliniquement pertinents.
Nivolumab en association à l'ipilimumab et à une chimiothérapie
Lorsque nivolumab 360 mg toutes les 3 semaines est administré en
association à l'ipilimumab 1 mg/kg toutes les 6 semaines et à 2 cycles
de chimiothérapie, la clairance du nivolumab est diminuée d'environ 10
% et la clairance de l'ipilimumab est augmentée d'environ 22 %, ce qui
n'est pas considéré comme étant cliniquement pertinents.
Populations particulières
Une analyse pharmacocinétique de population suggère que les facteurs suivants n'avaient pas d'incidence sur la CL de nivolumab : âge, sexe, race, type de tumeur solide, taille de la tumeur et insuffisance hépatique. Bien que le statut ECOG, le taux de filtration glomérulaire (TFG) initial, le taux d'albumine, le poids corporel, et une insuffisance hépatique légère aient eu un effet sur la clairance de nivolumab, cet effet n'a pas été cliniquement significatif.
Population pédiatrique
Concernant le nivolumab en monothérapie, les expositions au nivolumab
chez les adolescents âgés de 12 ans et plus pesant au moins 50 kg
devraient être comparables à celles observées chez les patients adultes
à la dose recommandée. La posologie basée sur le poids est recommandée
pour les adolescents âgés de 12 ans et plus pesant moins de 50 kg.
Concernant le nivolumab en association avec l'ipilimumab, les expositions au nivolumab et à l'ipilimumab chez les adolescents âgés de 12 ans et plus devraient être comparables à celles observées chez les patients adultes à la dose recommandée.
Insuffisance rénale
L'effet d'une insuffisance rénale sur la CL de nivolumab a été évalué
chez des patients présentant une insuffisance rénale légère (TFG <
90 et ≥ 60 mL/min/1,73 m2 ; n = 379), modérée (TFG < 60 et ≥ 30 mL/min/1,73 m2 ; = 179), ou sévère (TFG < 30 et ≥ 15 mL/min/1,73m2 ; n = 2) comparativement à des patients présentant une fonction rénale normale (TFG ≥ 90 mL/min/1,73 m2
; n = 342) dans des analyses de pharmacocinétique de population. Il n'y
a pas eu de différence de CL de nivolumab cliniquement importante entre
les patients présentant une insuffisance rénale légère à modérée et les
patients présentant une fonction rénale normale. Les données chez les
patients avec une insuffisance rénale sévère sont trop limitées pour
tirer des conclusions dans cette population (voir rubrique Posologie et mode d'administration).
Insuffisance hépatique
L'effet d'une insuffisance hépatique sur la CL de nivolumab a été
évalué chez des patients présentant une insuffisance hépatique légère
(bilirubine totale (BT) 1,0 × à 1,5 × LSN ou ASAT > LSN selon la
définition des critères de l'insuffisance hépatique du NCI (National
Cancer Institute) ; n = 92) comparativement aux patients présentant une
fonction hépatique normale (BT et ASAT ≤ LSN ; n = 804) dans des
analyses de pharmacocinétique de population. Il n'y a pas eu de
différence cliniquement importante de la CL de nivolumab entre les
patients présentant une insuffisance hépatique légère et les patients
présentant une fonction hépatique normale. Nivolumab n'a pas été étudié
chez des patients présentant une insuffisance hépatique modérée (BT
> 1,5 × à 3 × LSN et quel que soit le taux d'ASAT) ou sévère (BT
> 3 × LSN et quel que soit le taux d'ASAT) (voirrubrique Posologie et mode d'administration).
Nivolumab ou nivolumab en association avec l'ipilimumab peut avoir une influence mineure sur l'aptitude à conduire des véhicules et à utiliser des machines. Du fait des effets indésirables potentiels, tels que la fatigue, (voir rubrique Effets indésirables), les patients doivent être prévenus qu'ils doivent être prudents lorsqu'ils conduisent ou utilisent des machines, tant qu'ils ne sont pas certains que nivolumab n'altère pas leur vigilance.
Le blocage du signal PD-L1 a montré chez des modèles murins de grossesse une perturbation de la tolérance au fœtus et une augmentation de la perte fœtale. Les effets du nivolumab sur le développement pré et postnatal ont été évalués chez des singes recevant nivolumab 2 fois par semaine, du début de l'organogénèse, durant le premier trimestre, jusqu'à l'accouchement, à des niveaux d'exposition de 8 à 35 fois supérieurs à ceux associés à la dose clinique de nivolumab de 3 mg/kg (basés sur l'AUC). Il y a eu une augmentation dose-dépendante du nombre d'avortements et de mortalité néonatale à partir du troisième trimestre.
Le reste de la descendance des femelles traitées par nivolumab a survécu jusqu'au terme prévu, sans signes cliniques liés au traitement, ni anomalies du développement, ni altération du poids des organes ou modifications pathologiques macro ou microscopiques. Les résultats des courbes de croissance, ainsi que les données de tératogénicité, neurocomportementales, immunologiques et les paramètres de pathologie clinique analysés pendant une période post-natale de 6 mois ont été comparables avec ceux du groupe contrôle. Cependant, basé sur son mécanisme d'action, l'exposition fœtale à nivolumab peut augmenter le risque de développer des troubles d'origine immunologique ou altérer la réponse immunitaire normale, et des troubles d'origine immunologique ont été rapportés chez des souris déficientes en PD-1.
Aucune étude de fertilité n'a été réalisée avec le nivolumab.
La préparation doit être réalisée par du personnel formé conformément aux règles de bonnes pratiques, particulièrement en ce qui concerne le respect de l'asepsie.
Préparation et administration
Calcul de la dose
Plus d'un flacon de solution à diluer d'OPDIVO peut être nécessaire pour administrer la dose totale au patient.
Nivolumab en monothérapie
La dose prescrite pour le patient adulte est de 240 mg ou 480 mg, administrés
indépendamment du poids du patient, en fonction de l'indication (voir rubrique Posologie
et mode d'administration).
Mélanome (avancé ou traitement adjuvant) chez les adolescents. La dose prescrite pour les adolescents
âgés de 12 ans et plus pesant au moins 50 kg est de 240 mg ou 480 mg. Pour les adolescents âgés de
12 ans et plus pesant moins de 50 kg, la dose prescrite est indiquée en mg/kg. En fonction de cette
dose prescrite, calculer la dose totale à administrer.
▪ La dose totale de nivolumab en mg = le poids du patient en kg × la dose prescrite en mg/kg.
▪ Le volume de solution à diluer d’OPDIVO pour préparer la dose (mL) = dose totale de
nivolumab en mg divisée par 10 (la concentration de la solution à diluer d’OPDIVO est de
10 mg/mL).
Nivolumab en association à l’ipilimumab
La dose prescrite pour le patient est donnée en mg/kg. En fonction de cette dose prescrite, calculer la
dose totale à administrer (voir ci-dessus).
Nivolumab en association à l'ipilimumab dans le MPM
La dose prescrite pour le patient est de 360 mg, administrés indépendamment du poids du patient.
Nivolumab en association à l'ipilimumab dans le CEO
La dose prescrite pour le patient peut être soit basée sur le poids du patient (3 mg/kg), soit de 360 mg administrés indépendamment du poids du patient.
Nivolumab en association à une chimiothérapie dans le CBNPC résécable
La dose prescrite pour le patient est de 360 mg, administrés indépendamment du poids du patient.
Nivolumab en association à une chimiothérapie dans le CEO
La dose prescrite pour le patient est de 240 mg ou 480 mg, administrés indépendamment du poids du patient.
Nivolumab en association à une chimiothérapie dans l'adénocarcinome gastrique, de la JOG ou de l'œsophage
La dose prescrite pour le patient est de 360 mg ou de 240 mg, administrés indépendamment du poids du patient.
Nivolumab en association à l'ipilimumab et à une chimiothérapie
La dose prescrite pour le patient est de 360 mg, administrés indépendamment du poids du patient.
Nivolumab en association au cabozantinib
La dose prescrite pour le patient de nivolumab est de 240 mg ou 480 mg g de nivolumab, administrés indépendamment du poids du patient.
La dose prescrite pour le patient est de 360 mg, administrés indépendamment du poids du patient.
Nivolumab en association à l'ipilimumab dans le CEO
La dose prescrite pour le patient peut être soit basée sur le poids du patient (3 mg/kg), soit de 360 mg administrés indépendamment du poids du patient.
Nivolumab en association à une chimiothérapie dans le CBNPC résécable
La dose prescrite pour le patient est de 360 mg, administrés indépendamment du poids du patient.
Nivolumab en association à une chimiothérapie dans le CEO
La dose prescrite pour le patient est de 240 mg ou 480 mg, administrés indépendamment du poids du patient.
Nivolumab en association à une chimiothérapie dans l'adénocarcinome gastrique, de la JOG ou de l'œsophage
La dose prescrite pour le patient est de 360 mg ou de 240 mg, administrés indépendamment du poids du patient.
Nivolumab en association à l'ipilimumab et à une chimiothérapie
La dose prescrite pour le patient est de 360 mg, administrés indépendamment du poids du patient.
Nivolumab en association au cabozantinib
La dose prescrite pour le patient de nivolumab est de 240 mg ou 480 mg g de nivolumab, administrés indépendamment du poids du patient.
Préparation
de la perfusion
S'assurer d'opérer dans des conditions aseptiques lorsque vous préparez la
perfusion.
OPDIVO peut être utilisé en administration
intraveineuse, soit :
▪ sans dilution, après transfert dans un récipient pour perfusion en utilisant une seringue stérile appropriée; ou
▪ après dilution, selon les instructions suivantes :
▪ la concentration finale de la perfusion doit être comprise entre 1 et 10 mg/mL.
▪ le volume total de la perfusion ne doit pas dépasser 160 mL. Pour les patients pesant moins de 40 kg, le volume total de la perfusion ne doit pas dépasser 4 mL par kilogramme de poids du patient.
La solution à diluer d'OPDIVO peut être diluée avec soit :
▪ une solution injectable de chlorure de sodium à 9 mg/mL (0,9 %) ; ou
▪ une solution injectable de glucose à 50 mg/mL (5 %)
ETAPE 1
▪ Inspecter la solution à diluer d'OPDIVO pour mettre en évidence la présence de particules étrangères ou d'une coloration anormale. Ne pas secouer le flacon. La solution à diluer d'OPDIVO est un liquide clair à opalescent, incolore à jaune pâle. Jeter le flacon si la solution est trouble, d'une coloration anormale, ou contient un type de particules autre que quelques particules translucides à blanches.
▪ Retirer le volume nécessaire de solution à diluer d'OPDIVO en utilisant une seringue stérile de volume approprié.
ETAPE 2
▪ Transférer la solution à diluer dans une bouteille en verre stérile et évacuée, ou dans un récipient pour perfusion (PVC ou polyoléfine).
▪ Le cas échéant, diluer avec le volume nécessaire de solution injectable de chlorure de sodium à 9 mg/mL (0,9 %) ou de solution injectable de glucose à 50 mg/mL (5 %). Afin de faciliter la préparation, la solution à diluer peut directement être transvasée dans une poche pré-remplie contenant le volume approprié de solution injectable de chlorure de sodium à 9 mg/mL (0,9 %) ou de solution injectable de glucose à 50 mg/mL (5 %).
▪ Mélanger doucement la perfusion par rotation manuelle. Ne pas secouer.
▪ sans dilution, après transfert dans un récipient pour perfusion en utilisant une seringue stérile appropriée; ou
▪ après dilution, selon les instructions suivantes :
▪ la concentration finale de la perfusion doit être comprise entre 1 et 10 mg/mL.
▪ le volume total de la perfusion ne doit pas dépasser 160 mL. Pour les patients pesant moins de 40 kg, le volume total de la perfusion ne doit pas dépasser 4 mL par kilogramme de poids du patient.
La solution à diluer d'OPDIVO peut être diluée avec soit :
▪ une solution injectable de chlorure de sodium à 9 mg/mL (0,9 %) ; ou
▪ une solution injectable de glucose à 50 mg/mL (5 %)
ETAPE 1
▪ Inspecter la solution à diluer d'OPDIVO pour mettre en évidence la présence de particules étrangères ou d'une coloration anormale. Ne pas secouer le flacon. La solution à diluer d'OPDIVO est un liquide clair à opalescent, incolore à jaune pâle. Jeter le flacon si la solution est trouble, d'une coloration anormale, ou contient un type de particules autre que quelques particules translucides à blanches.
▪ Retirer le volume nécessaire de solution à diluer d'OPDIVO en utilisant une seringue stérile de volume approprié.
ETAPE 2
▪ Transférer la solution à diluer dans une bouteille en verre stérile et évacuée, ou dans un récipient pour perfusion (PVC ou polyoléfine).
▪ Le cas échéant, diluer avec le volume nécessaire de solution injectable de chlorure de sodium à 9 mg/mL (0,9 %) ou de solution injectable de glucose à 50 mg/mL (5 %). Afin de faciliter la préparation, la solution à diluer peut directement être transvasée dans une poche pré-remplie contenant le volume approprié de solution injectable de chlorure de sodium à 9 mg/mL (0,9 %) ou de solution injectable de glucose à 50 mg/mL (5 %).
▪ Mélanger doucement la perfusion par rotation manuelle. Ne pas secouer.
Administration
La perfusion d'OPDIVO ne doit pas être administrée en IV rapide ni en bolus IV.
Administrer la perfusion d'OPDIVO par voie intraveineuse sur une période de 30
ou 60 minutes selon la posologie.
La solution d'OPDIVO ne doit pas être perfusée simultanément avec d'autres médicaments sur la même ligne intraveineuse. Utiliser une ligne intraveineuse séparée pour la perfusion.
Utiliser un set de perfusion et un filtre en ligne stérile, apyrogène, à faible liaison aux protéines (diamètre des pores de 0,2 µm à 1,2 µm).
La perfusion d'OPDIVO est compatible avec les poches en PVC et en polyoléfine, les flacons en verre, les sets de perfusion en PVC, et les filtres en ligne avec membranes en polyéthersulfone et tailles de pores de 0,2 µm à 1,2 µm.
Après administration de la dose de nivolumab, rincer la ligne de perfusion avec une solution injectable de chlorure de sodium à 9 mg/mL (0,9 %) ou une solution injectable de glucose à 50 mg/mL (5 %).
Elimination
Ne pas conserver toute fraction inutilisée de la solution pour perfusion en vue
d'une réutilisation. Tout médicament non utilisé ou déchet doit être éliminé
conformément à la réglementation en vigueur.
Liste I.
Médicament nécessitant une surveillance particulière pendant le traitement.
Prescription réservée aux médecins compétents en maladie du sang.
Prescription réservée aux spécialistes et services CANCEROLOGIE.
Prescription réservée aux spécialistes et services HEMATOLOGIE.
Prescription réservée aux spécialistes et services ONCOLOGIE MEDICALE.
Réservé à l'usage HOSPITALIER
Agrément
aux collectivités :
Les seules indications thérapeutiques ouvrant droit
à la prise en charge par l'assurance maladie sont :
- En association à une chimiothérapie combinée à base de fluoropyrimidine et de sels de platine, en première ligne, dans le traitement des patients adultes atteints d'un carcinome épidermoïde de l'œsophage avancé non résécable, récurrent ou métastatique dont les cellules tumorales expriment PD-L1 au seuil = 1 %. (JO du 16/06/2023).
- En monothérapie dans le traitement adjuvant des
patients adultes atteints de carcinome urothélial infiltrant le muscle (CUIM) à
haut risque de récidive après exérèse complète, dont les cellules tumorales
expriment PD-L1 au seuil = 1 % : - ayant reçu une chimiothérapie néoadjuvante ;
- ou n'ayant pas reçu de chimiothérapie néoadjuvante et non éligibles/ou ayant
refusé une chimiothérapie adjuvante à base de cisplatine ; - en association à
une chimiothérapie combinée à base de fluoropyrimidine et de sels de platine, en
première ligne de traitement, dans le traitement des patients adultes atteints
d'un adénocarcinome gastrique, de la jonction oeso-gastrique ou de l'oesophage
avancé ou métastatique, HER-2 négatif, dont les tumeurs expriment PD-L1 avec un
score positif combiné (Combined Positive Score : CPS) = 5. (JO du
10/03/2023)
- Uniquement en monothérapie dans le traitement adjuvant
des patients adultes atteints d'un cancer de l'œsophage ou de la jonction
œsogastrique et qui ont une maladie résiduelle après une radiochimiothérapie
néoadjuvante antérieure et une résection complète (R0 post-chirurgie) dans les 4
à 16 semaines. (JO du 21/06/2022).
- L'association OPDIVO/YERVOY est indiquée
dans le traitement de 1re ligne des patients adultes atteints de mésothéliome
pleural malin non résécable. (JO du 15/02/2022).
- Traitement des patients
adultes atteints d'un lymphome hodgkinien classique (LHc) en rechute ou
réfractaire après une greffe de cellules souches autologue (GCSA) et un
traitement par brentuximabvedotin (JO du 29/11/2017).
- En monothérapie dans
le traitement des patients adultes atteints d'un cancer épidermoïde de la tête
et du cou en progression pendant ou après une chimiothérapie à base de sels de
platine (JO du 05/06/2018).
- En association à l'ipilimumab, en 1ère ligne de
traitement du mélanome au stade avancé chez des patients ECOG 0 ou 1, dont la
tumeur est B-RAF non muté, ne présentant pas de métastase cérébrale active et
avec une administration dans des centres disposant d'une réanimation médicale
polyvalente ou équivalent (JO du 19/12/2017).
- Traitement des patients
adultes atteints d'un cancer bronchique non-à-petites cellules (CBNPC) de type
non épidermoïde localement avancé ou métastatique après une chimiothérapie
antérieure uniquement chez les patients en bon état général (ECOG 0 ou 1) (JO du
04/03/2017).
- En monothérapie dans le traitement des patients adultes
atteints d'un mélanome avancé (non résécable ou métastatique) (JO du
27/12/2016).
- Traitement des patients adultes atteints d'un cancer
bronchique non à petites cellules (CBNPC) de type épidermoïde localement avancé
ou métastatique après une chimiothérapie antérieure (JO du 27/12/2016).
-
Traitement du cancer du rein à cellules claires ou comportant un contingent de
cellules claires au stade avancé après échec d'un traitement antérieur par
anti-VEGF (JO du 27/12/2016).
- Traitement adjuvant en monothérapie des
patients adultes atteints d'un mélanome avec atteinte des ganglions lymphatiques
ou une maladie métastatique, et ayant subi une résection complète (JO du
16/07/2019).
- Traitement de 1re ligne au stade avancé du carcinome rénal à
cellules claires ou comportant un contingent de cellules claires de pronostic
intermédiaire ou défavorable. (JO du 03/03/2020).
Solution à diluer pour perfusion (solution à diluer stérile).
Solution claire à opalescente, incolore à jaune pâle, pouvant contenir quelques particules légères. Le pH de la solution est approximativement de 6,0 et l'osmolarité approximativement de 340 mOsm/kg.
4 mL de solution à diluer stérile en flacon de 10 mL (verre de type I) muni d'un bouchon (caoutchouc butyl enrobé) et d'un opercule amovible (aluminium). Boîte de 1 flacon.
Chaque mL de solution à diluer pour perfusion contient 10 mg de nivolumab.
Un flacon de 4 mL contient 40 mg de nivolumab.
Nivolumab est produit sur des cellules ovariennes de hamster chinois, par la technologie de l'ADN recombinant.
Excipient à effet notoire :
Chaque mL de solution à diluer contient 0,1 mmol (ou 2,5 mg) de sodium.
Pour la liste complète des excipients, voir rubrique Liste des excipients.
Citrate de sodium dihydraté
Chlorure de sodium
Mannitol (E421)
Acide pentétique (acide diéthylène-triamine-penta-acétique)
Polysorbate 80 (E433)
Hydroxyde de sodium (pour ajustement du pH)
Acide chlorhydrique (pour ajustement du pH)
Eau pour préparations injectables
Hydroxyde de sodium (pour ajustement du pH)
Acide chlorhydrique (pour ajustement du pH)
Eau pour préparations injectables